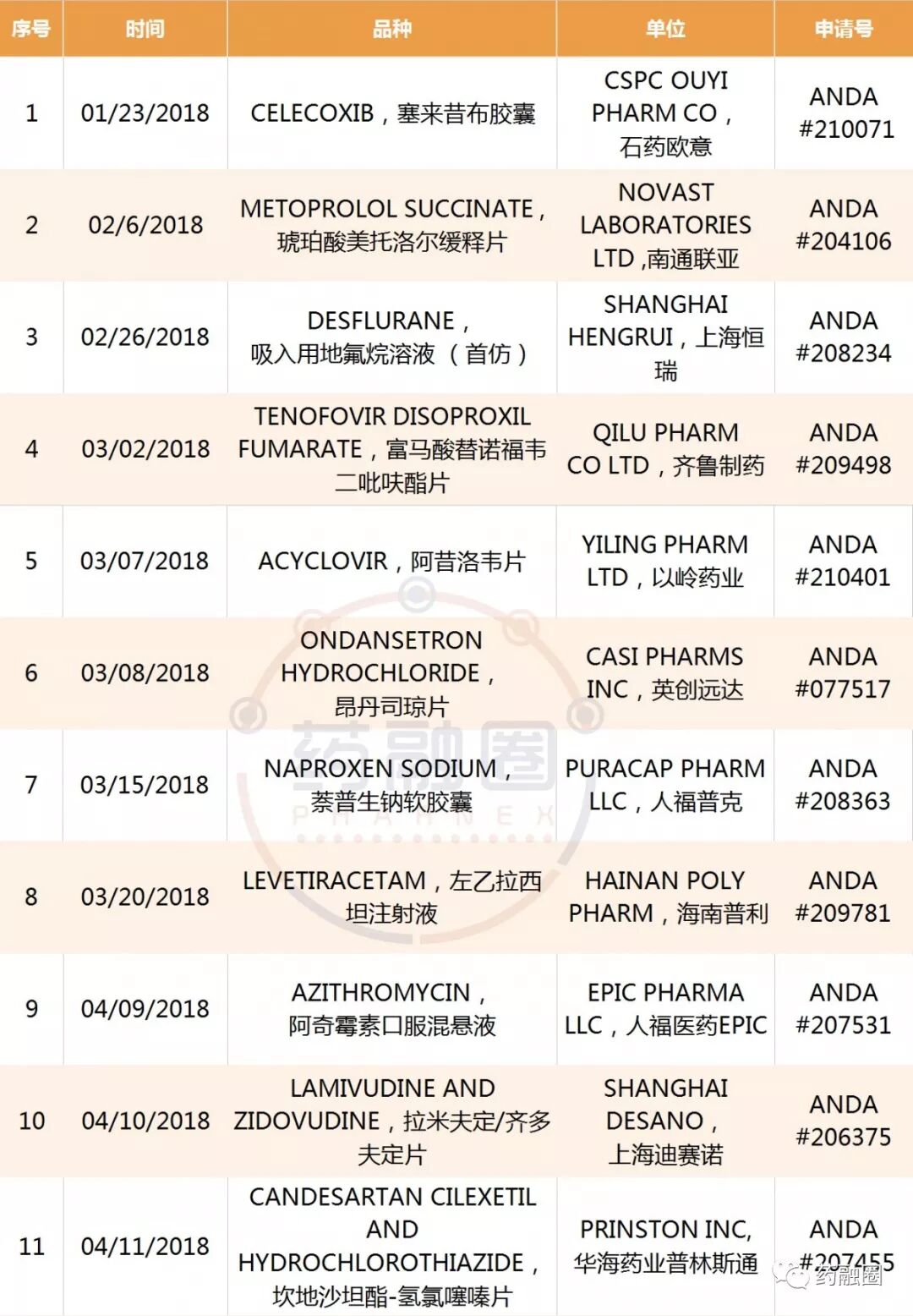
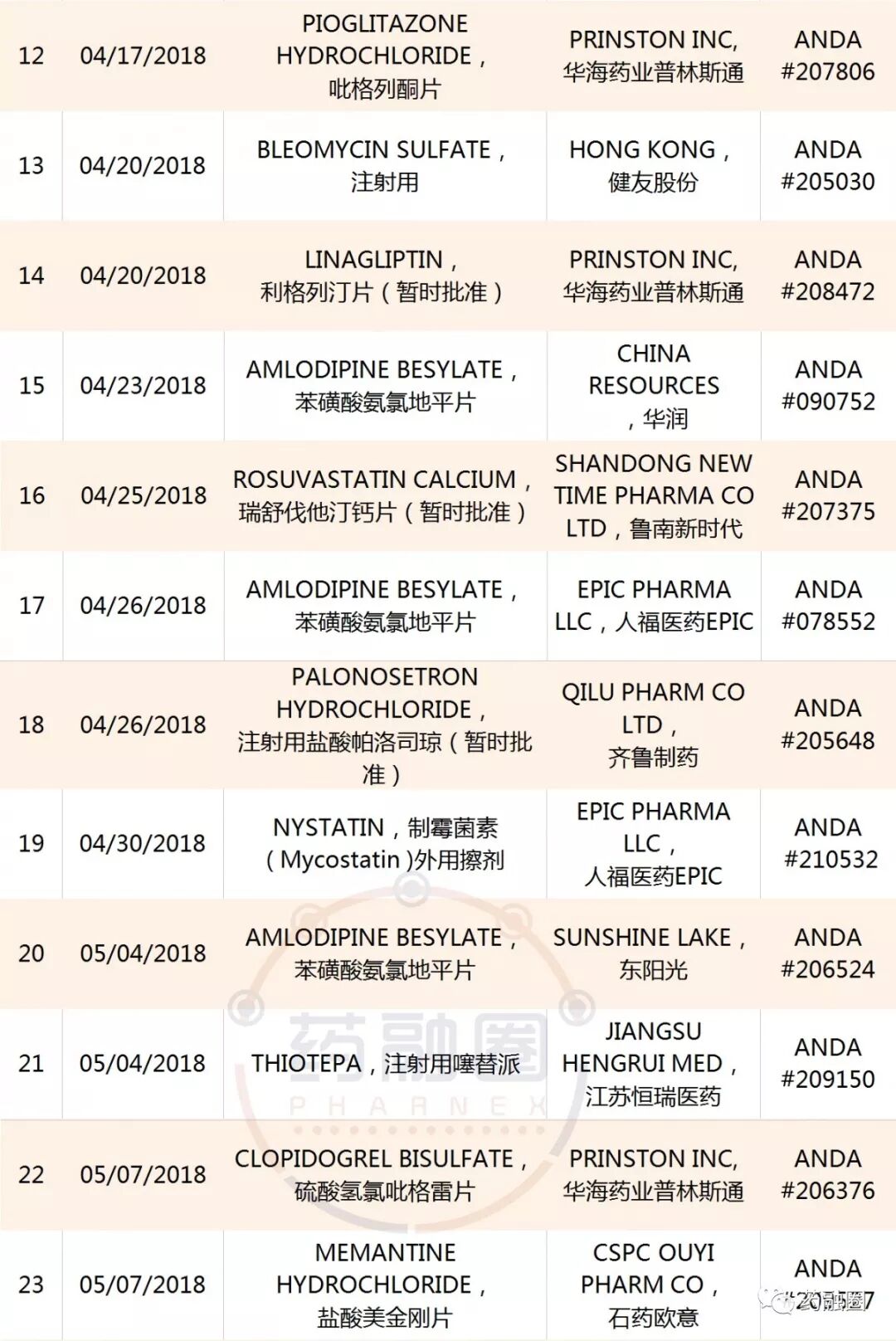
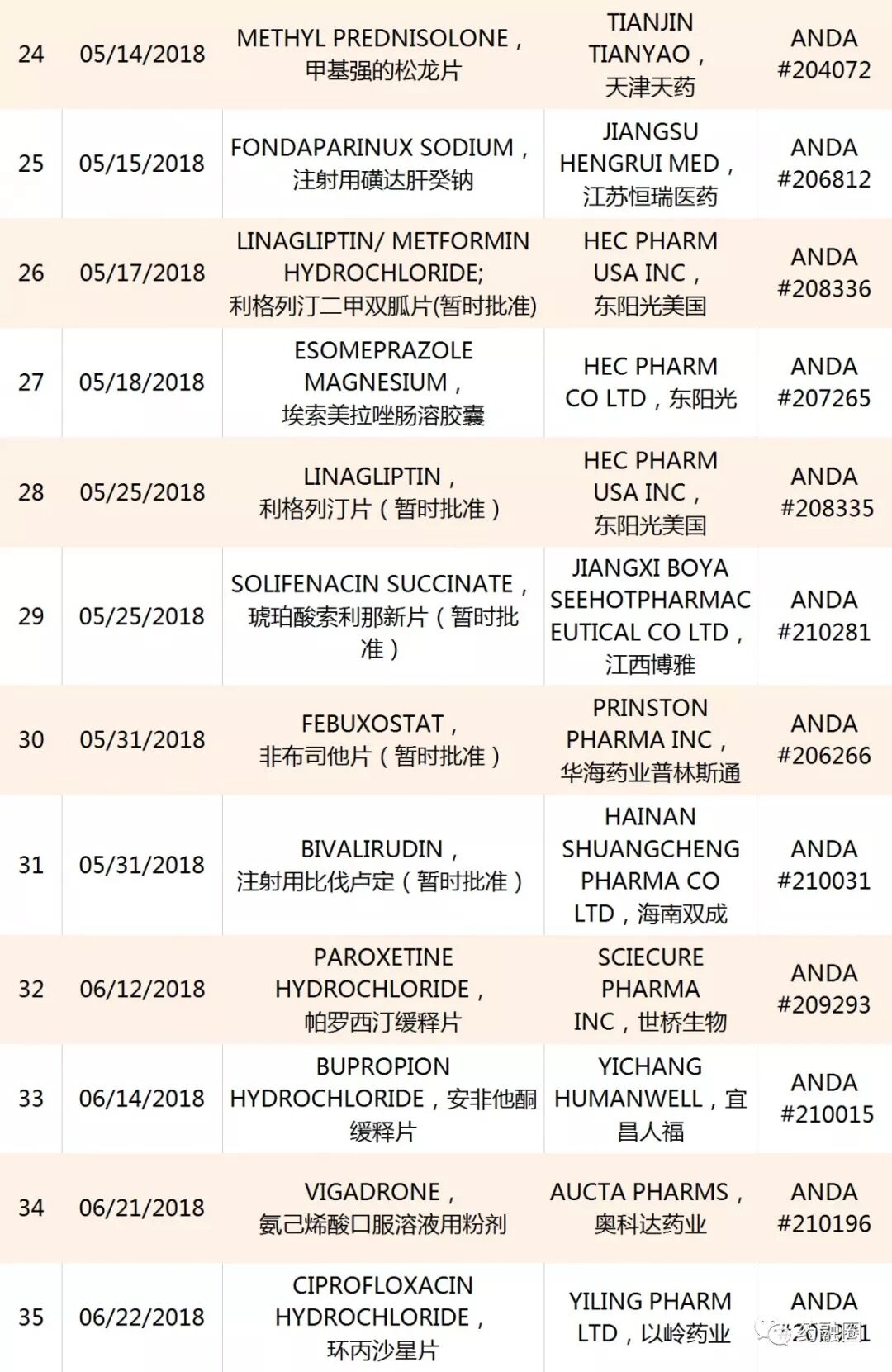
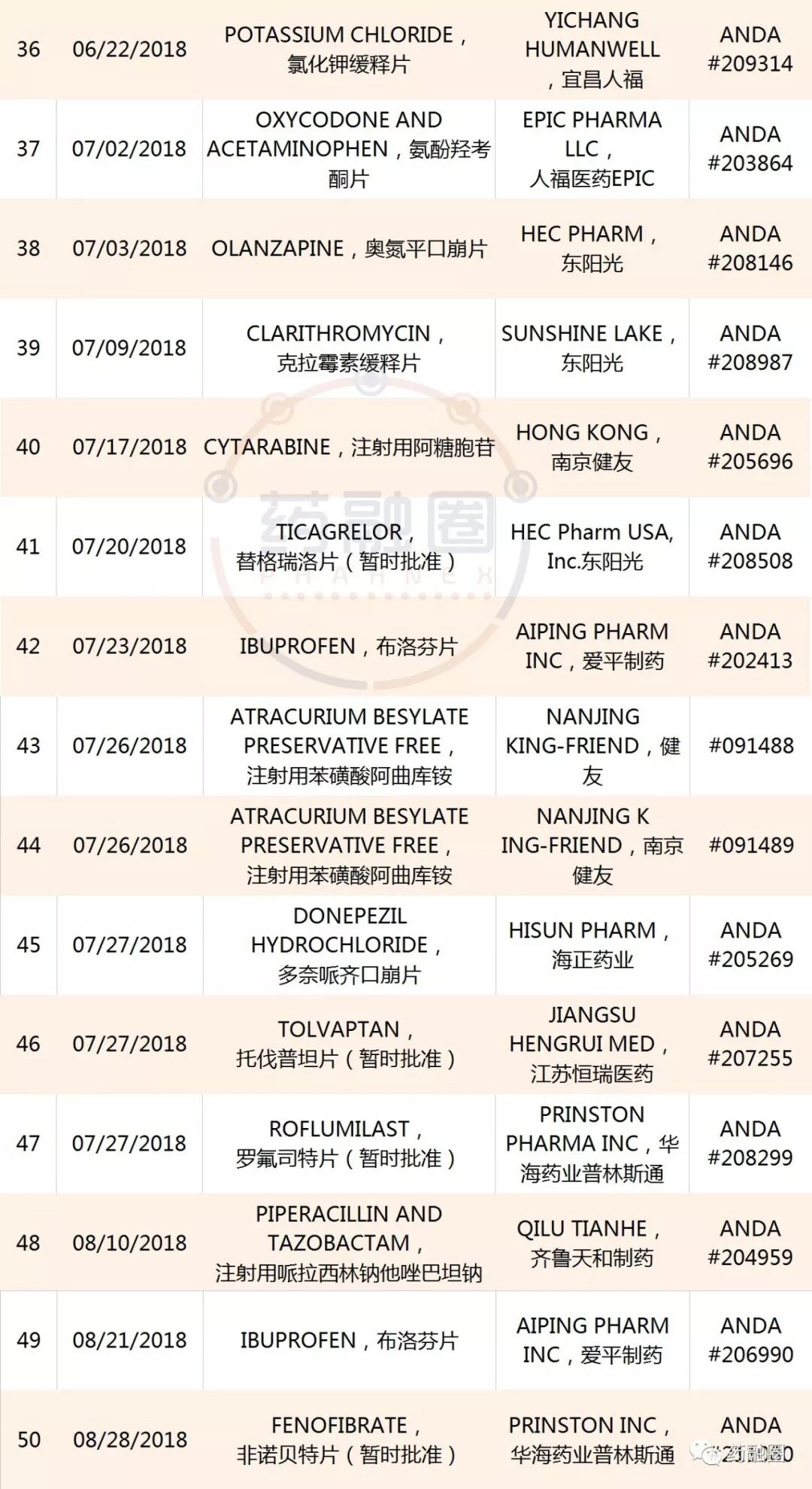
中國藥企迄今獲得的50個ANDA
日期:2018/9/24
越來越多的制藥企業,立足國內市場,積極開拓美國和歐洲市場!批文數不斷累積,但是制劑營收除恒瑞醫藥、華海藥業、南通聯亞、人福醫藥、齊魯制藥以外的企業,對美出口業績較小。據中國醫藥保健品進出口商會:2018年一季度,中國對美國化藥制劑出口額超過9000萬美元,同比增長18.8%。上述5家位居出口前列,占制劑總出口額的67%。
中國藥企2018至今年獲得的ANDA,截止09/12/2018
注:
1. Aucta Pharmaceuticals, Inc. (AUCTA,奧科達在拉丁語中的意思是“ 改進的”,“更好的”);
2. SCIECURE PHARMA INC,世橋生物,布地奈德膠囊3mg于2017年09月28日獲美國FDA上市許可(ANDA),世橋生物第一個獲得ANDA的產品;
3. HONG KONG,公司母公司為南京健友,名字比較隱蔽;
4. AIPING PHARM INC,愛平制藥,不認真還看不出是國內企業…,安士制藥A&Z Pharmaceutical,隸屬于百洋醫藥集團;
5. TWI PHARMS早前被PAR收購,并不是我國臺灣地區公司了;
6. 暫時性批準(Tentative Approval)的企業品種有12個;
7. 2018年9月12日,浙江華海藥業公告,其制劑產品鹽酸二甲雙胍緩釋片獲得美國FDA批準文號。
鹽酸二甲雙胍緩釋片由百時美施貴寶公司(Bristol Myers Squibb)研發,于2000年在美國上市。目前在中國市場,也有多家藥企生產該產品。華海藥業目前在鹽酸二甲雙胍緩釋片項目上已投入研發費用約600萬元人民幣;
8. https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ApprovedDrugProductswithTherapeuticEquivalenceEvaluationsOrangeBook/default.htm;https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=reportsSearch.process;
延伸閱讀:
1、ANDA申請
Abbrevitive New Drug Application(簡略新藥申請),簡稱ANDA。根據美國《食品、藥品和化妝品法》(FDCA)及美國聯邦管理法21 CFR Part 21,專利期過后的通用名藥均按此程序申請上市。
但是,《藥品價格競爭和專利期恢復法(Waxman-Hatch Act)》并不適用于生物制品,即生物制品不能按ANDA批準上市。迄今已有不少試圖爭取生物制品仿制的游說,但尚無相關法律出臺。
美國的ANDA注冊相當于中國的仿制藥注冊,相對新藥注冊要簡單。根據中國實際情況,在美國進行仿制藥注冊,即ANDA 申請,適合中國的大中型藥廠。印度在這方面遠領先于中國,目前約30%的ANDA是由印度廠家申請的。
2、ANDA申請人資格
ANDA的申請人可以是“任何人”(any person),即原則上不必是公司(法人),也不區分國別,而且,ANDA的申請人和有關的《公民請愿書》請愿人均可是非美國公民。
但在實際操作上,ANDA應該有足以處理問題的美國代理人,與FDA保持聯絡,處理注冊事宜。
3、擬注冊藥品的資格
擬向FDA申請ANDA的藥品,應為已被FDA批準上市的,在《經治療等同性評價批準的藥品(橙皮書)》中收載并指定參比制劑(Reference Listed Drug)的藥品。
如申請人擬仿制在《橙皮書》中收載但并未制定參比制劑的藥品,須先提交《公民請愿書》請求FDA將該藥品指定為參比制劑。
擬申請ANDA的藥品,其活性成分、劑型、規格、給藥途徑、適應癥必須與參比制劑相同,若擬申請ANDA的藥品的上述條件與參比制劑不同,則需先遞交有關《公民請愿書》,獲得FDA批準之后,方能提出ANDA申請。
擬申請ANDA的藥品,必須與參比制劑具有生物等效性。
擬申請ANDA的藥品,必須按照美國聯邦管理法21 CFR遵行藥品生產管理規范控制生產過程。
|