新局長第一把火燒向中藥,不到半月三次向中藥注射劑開炮
日期:2018/6/30
6月12日,國家藥品監督管理局發布《關于修訂丹參注射劑說明書的公告》,要求所有丹參注射劑生產企業按照修訂要求提交修訂說明書的補充申請,并于2018年8月15日前報省級食品藥品監管部門備案。
這是多么似曾相識的一幕。就在一天前,國家藥品監督管理局還發布了《關于修訂雙黃連注射劑說明書的公告》。5月29日,發布了關于修訂柴胡注射液說明書的公告。
丹參注射劑、雙黃連注射劑、柴胡注射液……這些都是中藥注射劑領域由來已久的市場大品種。在不到半個月的時間中接連三次要求知名中藥注射劑大品種修改說明書,這種連續密集的出招已經將藥監局接下來將對中藥領域進行一場大核查的意圖顯露無疑。
信號來了!
藥監局新局長上任之后,第一把火果然燒向了中藥領域,并且這把火來得比想象中的更快。畢竟,連續點名三個知名中藥注射劑大品種,其中的寓意已經不言而名。尤其是在中藥注射劑歷來因安全性與不良反應而頻遭詬病的情況下,這樣的動作顯然更容易引起行業的動蕩。
從當前的趨勢可以看出,針對中藥領域的核查,第一場風暴已經從中藥注射劑領域開始刮起。而明星品種、大品種或許將首當其沖,其中波及的企業數量將相當可觀。
僅以丹參注射劑為例,藥監局官網查詢可知,該產品共涉及注冊批文73個,生產企業45家。丹參滴注液的批文2個,涉及2家藥企、注射用丹參(凍干)的批文1個,涉及1家藥企。
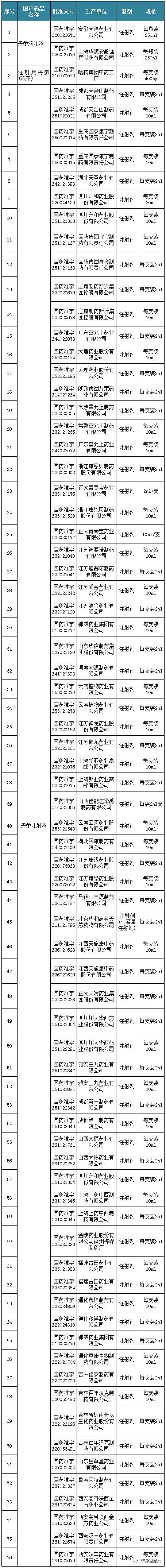
圖片來源:醫藥地方臺
一直以來,中藥制劑類企業都是歷次核查、飛檢中出現問題的重災區。國家藥監局最新發布的《2017年度藥品檢查報告》顯示,在被進行飛行檢查的57家企業中,中藥制劑生產企業占比高達49%。而全年飛檢中發現存在問題的39家企業中,有27家問題嚴重的企業要求省局收回GMP證書或立案查處。其中,中藥類生產企業飛行檢查結果顯示,29家企業不符合相關要求,其中21家企業被收回藥品GMP證書。
而在其中,中藥注射劑又尤其以頻發的不良反應而屢被詬病。例如此次被要求修改說明書的丹參注射液。2018年4月,四川升和藥業股份有限公司便由于其生產的丹參注射液部分批次在個別地區發生聚集性不良反應,而對相關批次產品實施二級召回。而值得注意的是,該企業多年之前就因丹參注射液發生不良事件而被要求全面停產,很明顯直到現在,其中存在的問題仍然沒有得到解決。
而其他明星中藥注射劑產品的不良反應事件同樣并不罕見。例如去年9月份山西振東安特生物制藥有限公司紅花注射液和江西青峰藥業有限公司喜炎平注射液因質量問題而被原CFDA官方通報,并要求立即停止產品銷售并嚴查藥品質量。
中藥注射劑再評價:重生或死亡
一面是臨床上大規模的使用,一面是對其安全性、有效性的質疑,多年以來,中藥注射劑的去留一直是處于風口浪尖的熱門話題。不管是最早的魚腥草注射劑事件,去年的喜炎平、紅花注射液事件,還是最近的三起修改說明書通告,關于中藥注射劑安全性的爭論就從未停止。有人說這是“中藥注射劑的原罪”,也有人認為作為解放后“大干快上”的產物,中藥注射劑的發展有其歷史背景,雖有不足但也正在與時俱進發展,不能“一棍子打死”。
但不管如何,從當前的政策環境來看,對于中藥注射劑的限制早已是不爭的事實。2017年2月,人社部公布了2017年國家醫保目錄,其中最引人關注的地方之一,便在于對中藥注射劑的使用明確提出了顯示,共有37個中藥注射劑限用于二級及以上醫療機構、限用于重癥。
而各地關于輔助用藥的重點監控通知似乎更宣示著“中國式神藥”的時代即將落幕。一大批中藥注射液在甘肅、江蘇、安徽等地先后被列入重點監控目錄,這意味著醫院再使用此類藥品將十分慎重,每月的處方量將嚴格受限。據E藥經理人梳理,公開資料顯示,受限于輔助藥目錄部分品種銷量下滑達40%以上,這更讓中藥注射劑生產企業備感焦慮。
而在這種情況下,對于中藥注射液企業來說,開展再評價工作或許是其扳回一城的唯一戰場,但也有可能是加速其死亡的一把利器。這對企業來說是一場最為現實的考驗,通過再評價尚有一絲機會,否則很容易全盤皆輸。
總而言之,這已經不再是靠營銷方法以及基層市場放量就能保證企業生存的時代了,而未來中藥注射劑能否在趨嚴的政策環境與市場環境之中生存下來,就看這場中藥注射劑與自身的實打實較量結果如何了。
信息來源:E藥經理人
|