國家藥監(jiān)局“怒”了:飛檢38家藥企3/4不合規(guī)!21家收回GMP!
日期:2018/6/13
今年,中藥飲品及中藥制劑,將成為央地藥監(jiān)部門抽檢、飛檢的重中之重。
日前,國家藥監(jiān)局發(fā)布的《2017年度藥品檢查報告》顯示:在開展飛行檢查的38家中藥類生產企業(yè)中,共有29家企業(yè)(占總數(shù)的76.3%,逾3/4)不符合相關要求,其中,21家企業(yè)被收回藥品GMP證書;符合要求的僅有7家企業(yè),2家企業(yè)已無相關生產資質。
中藥生產企業(yè)不合格率為何如此之高?!國家藥監(jiān)局在上述《藥檢報告》中總結如下
-
中成藥生產企業(yè)主要問題為“不按處方標準投料”、“違背法定制法,擅自改變工藝”、“為應對監(jiān)督檢查,編造相關記錄文件”。
-
中藥飲片生產企業(yè)存在問題涉及“外購飲片直接分裝、銷售”、“未按照標準對購入或銷售的中藥材、中藥飲片進行全檢”、“批生產記錄不真實”。
-
在計劃中的2家和延伸檢查的3家中藥提取物生產企業(yè)中,還發(fā)現(xiàn)了私自提取和收購劣質中藥提取物再加工的行為。
而從國家藥監(jiān)局和各地藥品監(jiān)管部門發(fā)布的2018年檢查計劃來看,中藥飲片、中藥制劑等仍是重中之重。
分析人士指出,雖然國家層面大力鼓勵發(fā)展中醫(yī)藥,但對具體企業(yè)而言,要想打好政策賦予的一把好牌,還是要專心解決規(guī)范生產問題。
對中藥類企業(yè)而言,做到規(guī)范生產似乎并不容易。
從源頭上看,中藥飲片早已成為GMP被收回的“重災區(qū)”。原國家食藥監(jiān)管總局發(fā)布的數(shù)據顯示,2015年至2017年認證范圍為中藥飲片的藥品均占全年被收回GMP證書的半數(shù)左右:2015年,全年收回82張,占收回總數(shù)的56.9%;2016年收回90張,占總數(shù)的52.6%;2017年收回76張,占總數(shù)的48.4%。
而中藥制劑生產不合規(guī)情況似乎更嚴重。
在去年國家藥品監(jiān)管部門飛檢發(fā)現(xiàn)嚴重問題的品種中,56%為中藥制劑,13%為中藥飲片。
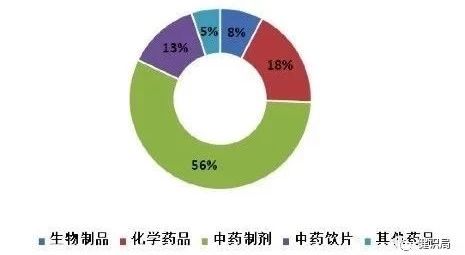
▲ 藥品飛行檢查發(fā)現(xiàn)嚴重問題的品種分布情況
而作為中藥制劑中最受爭議的成員,擁有千億市場規(guī)模的中藥注射液,雖然已引入現(xiàn)代工藝,但其生產中的問題,更加決定生死,不容忽視。
除了缺少臨床試驗數(shù)據證明其有效性外,生產過程不合規(guī)導致的不良反應現(xiàn)象也是藥監(jiān)部門關注的重點,特別是熱原合規(guī)問題。
熱原是造成寒戰(zhàn)、發(fā)熱,乃至死亡等不良反應的重要原因。
去年9月被通報、召回、停用的山西振東的紅花注射液,其被召回的主要原因即為“熱原不符合規(guī)定”。此前,生脈注射液等多種產品也因“熱原不符合規(guī)定”而遭到召回、停用等處理。
熱原可以通過原料、溶劑、容器具帶入,制備過程中污染,滅菌不徹底或包裝不嚴也產生熱原。而中藥注射劑的原料是草藥,來源復雜,容易產生熱原。也正因為如此,熱原也被稱為中藥注射液的“原罪”。這也是,今年10月國務院提出:力爭用5-10年完成注射劑上市后再評價工作后,業(yè)界一致唱衰中藥注射液的原因之一。
無論行業(yè)怎么看,對于相關企業(yè)而言,這既是挑戰(zhàn)也是自證清白的機會。步長制藥總裁趙超就曾表示,已對其主打產品丹紅注射液開展再評價工作,相信通過臨床試驗數(shù)據,證明其通過嚴格的生產過程控制,可以控制熱原風險,從而繼續(xù)保有市場。
事實上,中藥飲片、中藥制劑一直是,并將繼續(xù)是藥品檢查的重點。
藥品檢查報告顯示,2017年藥監(jiān)部門針對中藥制劑、中藥飲片、中藥提取物生產企業(yè)共派出30個檢查組129人次進行飛行檢查。
而在近日發(fā)布的《2018年藥品跟蹤檢查計劃》中,本著“雙隨機、一公開”原則,國家藥監(jiān)局計劃對全國共計201家藥品生產企業(yè)逐一開展現(xiàn)場檢查。其中,2017年抽檢問題較多的38家將是檢查重點。
雖然,沒有明確提到中藥類生產企業(yè),但從2017年的檢查結果來看,相關企業(yè)仍將是檢查重點。
而從各地情況來看,針對中藥類生產企業(yè)的檢查,已列入寧夏、福建、湖南等多個省份的2018年藥品檢查計劃
◆ 1月10日,寧夏食藥監(jiān)局印發(fā)《關于2018年藥品生產企業(yè)監(jiān)督檢查計劃的通知》:將重點檢查注射劑及無菌制劑、中標的基本藥物品種、貴細藥材的中藥制劑、生產工藝較難控制及產量大的品種、不良反應多或嚴重的品種、抽檢不合格的品種、新批準的新藥和仿制藥品種、國家藥品抽驗發(fā)出質量風險提示的品種等。
◆ 2月24日,山東省印發(fā)《2018年全省藥品生產環(huán)節(jié)監(jiān)督檢查計劃》:聚焦各類風險信號,繼續(xù)強化高風險品種、膠劑、中藥(含中藥飲片、中藥提取物、中藥制劑)、原料藥、特殊藥品等重點領域治理力度,重點查處生產過程中擅自變更工藝、摻雜使假、數(shù)據造假等違法違規(guī)行為,深度分析研判風險信息,采取防控措施,堅決防范系統(tǒng)性風險、區(qū)域性風險和產品質量風險。
◆ 2月26日,安徽省發(fā)布的《2018年全省藥品化妝品生產、特殊藥品監(jiān)督檢查計劃的通知》中,列出70個重點檢查品種,涉及中藥制劑27個;中藥飲片20個。同時明確將持續(xù)開展中藥飲片生產整治;并對中藥注射劑等高風險品種企業(yè)全覆蓋監(jiān)督檢查。
◆ 3月初,福建省召開“2018年全省藥品生產監(jiān)管工作會議”,部署2018年藥檢工作:將針對風險隱患進行整治,并持續(xù)開展“防風行動5”“追風行動2”,進一步加大中藥飲片質量監(jiān)管力度,依法查處一批生產假劣藥品行為,確保福建省中藥飲片質量安全。
◆ 3月8日至9日,湖南省召開藥品注冊生產監(jiān)管工作會議,明確:根據近年來藥品質量風險,擬組織中藥飲片、化學原料藥、無菌藥品(注射劑)、多組分生化藥品、中藥提取物及膠類產品等五個專項檢查,開展風險品種全程專項檢查。
◆ 3月13日,黑龍江省發(fā)布《2018年藥品生產監(jiān)管工作要點的通知》:將持續(xù)繼續(xù)開展突出問題專項整治,范圍包括中藥飲片質量提高、中藥注射劑質量、多組分生化藥安全性、醫(yī)療機構制劑室專項檢查、中藥提取物的合法來源、數(shù)據可靠性等。
◆ 3月28日,西藏自治區(qū)印發(fā)《2018年全區(qū)藥品化妝品監(jiān)管重點工作安排》:結合近年來對藥品生產企業(yè)監(jiān)督檢查、抽驗及不良反應監(jiān)測、風險提示、投訴舉報情況,以防控風險為目的,圍繞品種實施檢查,對中藥提取物、中藥飲片質量安全開展專項檢查,全面落實企業(yè)主體責任,保證藥品生產過程持續(xù)合規(guī),數(shù)據真實完整可追溯。
◆ 3月30日,江蘇省印發(fā)《2018年藥品生產監(jiān)管工作要點和監(jiān)督檢查計劃》:將開展7項專項檢查,包括:中藥注射劑生產企業(yè)、含鋁佐劑疫苗、含可待因復方口服溶液生產經營企業(yè)、出口歐盟第二類原料藥、F0>8與F0<8共線生產品種、多組分生化制劑外設提取車間或外購提取物企業(yè)、2017年度省局認證審評中心發(fā)出警告信的企業(yè)。
信息來源:健識局
|