【懲處】34家企業35批次中藥飲片不合格遭立案調查
日期:2017/3/28
3月24日,CFDA官網發布《關于35批次中藥飲片不合格的通告(2017年第48號)》。經陜西省食品藥品檢驗所檢驗,標示為陜西商洛盤龍植物藥業有限公司等34家企業生產的35批次中藥飲片不合格。
經陜西省食品藥品檢驗所檢驗,標示為安國祁安藥業有限公司、安國市輝發中藥飲片加工有限公司、吉林省澤康藥業有限公司、江蘇華康中藥飲片有限公司、杭州華東中藥飲片有限公司、安徽省萬生中藥飲片有限公司、安徽孟氏中藥飲片有限公司、北京同仁堂(亳州)飲片有限責任公司、亳州市永剛飲片廠有限公司、亳州市宏大中藥飲片科技有限公司、江西青春康源中藥飲片有限公司、江西藥都中藥飲片有限公司、江西樟樹天齊堂中藥飲片有限公司、河南千方藥業有限公司、湖北辰美中藥有限公司、湖南省弘華中藥飲片有限公司、邵陽神農中藥科技發展有限公司、廣東恒祥中藥飲片有限公司、廣西同福堂中藥飲片有限責任公司、南寧市萬藥堂藥業有限公司、海南國瑞堂中藥制藥有限公司、海南日中天制藥有限公司、重慶萬力藥業有限公司、四川中庸藥業有限公司、遵義市銀花藥業有限公司、云南新世紀中藥飲片有限公司、陜西商洛盤龍植物藥業有限公司、青海九康中藥飲片有限公司、寧夏明德中藥飲片有限公司等企業生產的35批次杜仲不合格。不合格項目包括含量測定、性狀。
對上述不合格中藥飲片,相關省(區、市)食品藥品監督管理局已采取查封扣押等控制措施,要求企業暫停銷售使用、召回產品,并進行整改。
CFDA要求生產企業所在地省(區、市)食品藥品監督管理局對上述企業依據《中華人民共和國藥品管理法》第七十三、七十四、七十五條等規定對生產銷售不合格產品的違法行為進行立案調查,三個月內公開對生產銷售不合格藥品相關企業或單位的處理結果,相關情況及時報告總局。
在立案調查工作中,企業對產品真實性有異議的,可以向所在地省(區、市)食品藥品監督管理局提出,由當地省(區、市)食品藥品監督管理局對企業生產銷售情況進行調查核實,并將情況通報被抽樣單位所在地省(區、市)食品藥品監督管理局。被抽樣單位所在地省(區、市)食品藥品監督管理局接到對不合格產品真實性異議的通報后,要立即立案調查,追溯產品來源。如確屬標示生產企業生產的,由相關省(區、市)食品藥品監督管理局對生產企業從重處罰。
35批次不合格中藥飲片名單
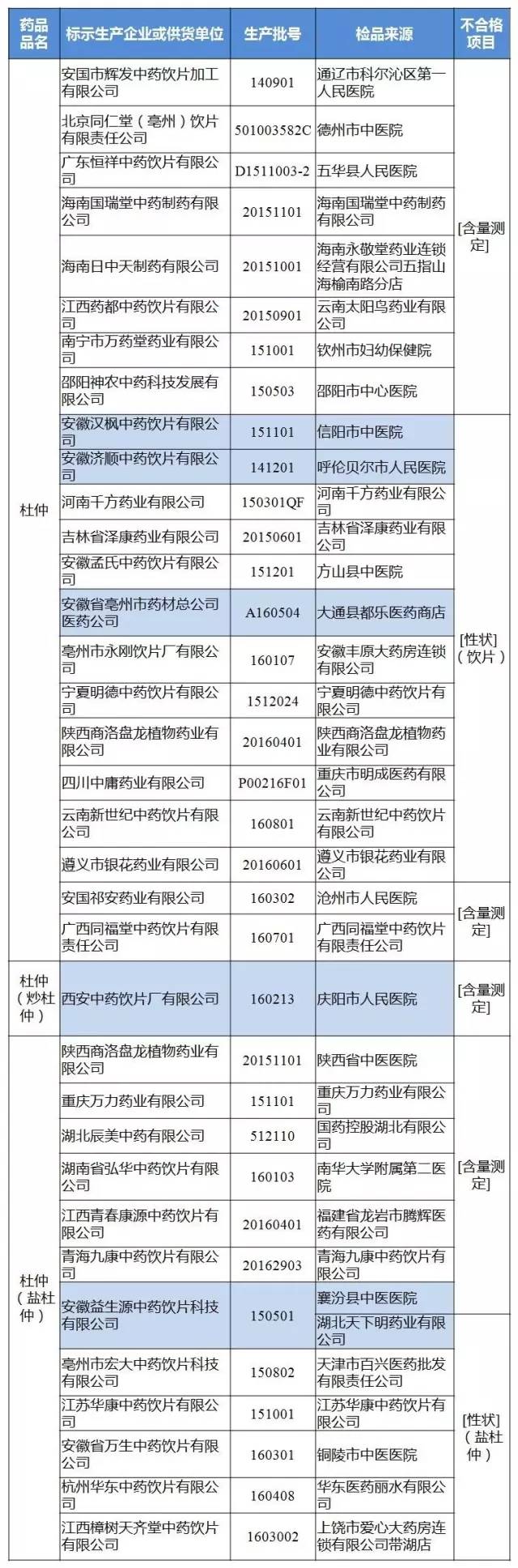
藍色部分藥品為標示生產企業否認為該企業生產
信息來源:醫藥經濟報
|