深圳GPO質量層次劃分標準出臺
日期:2016/8/13
深衛計通〔2016〕6號
為建立健全我市公立醫院藥品保障供應機制,確保改革試點工作的有效推進,根據《市衛生計生委關于印發深圳市推行公立醫院藥品集團采購改革試點實施方案的通知》(深衛計發〔2016〕63號),《市衛生計生委關于印發<深圳市公立醫院藥品集團采購目錄管理辦法(試行)>、<深圳市公立醫院藥品集團采購組織管理辦法(試行)>、<深圳市公立醫院藥品集團采購規定(試行)>的通知》(深衛計規〔2016〕4號),的有關精神和要求,我委組織起草了《市公立醫院藥品集團采購藥品質量層次劃分規則(征求意見稿)》和《市公立醫院藥品集團采購藥品目錄劑型整合規則(征求意見稿)》。現向社會公開征求意見。
歡迎社會各界人士提出修改意見和建議,并于2016年8月15日17:00前通過電子郵件或者傳真反饋我委。以個人名義反映意見和建議的應簽署本人真實姓名并提供聯系電話;以單位名義反映意見和建議的應加蓋本單位印章并提供聯系電話。我委對所反映的意見和建議,將認真進行研究,并視情況以適當方式將采納情況反饋到單位或個人。
市衛生計生委
2016年8月10日
附件1:市公立醫院藥品集團采購藥品質量層次劃分規則(征求意見稿)
一、第一層次
(一)專利藥品:
專利保護期內化合物專利、天然物提取物專利、微生物及其代謝物專利、組合物專利(其中至少某一有效成分為化合物專利)藥品。上述專利藥品生產企業授權或許可聯合生產的相應藥品(授權人對原廠原料、生產工藝、質量標準及質量一致認可的相關表述,以上四項同時具備)。以中華人民共和國知識產權局授予的,或原研制國家知識產權保護部門授予的發明專利證書為準。在其專利文件(發明專利證書、專利說明書、權利要求書)中應當有化合物專利、天然物提取物專利、微生物及其代謝物專利、組合物專利的名稱、結構或分子式等關鍵表述,保護的對象是化合物本身(不包括改變酸根、堿基、金屬元素、結晶形式等衍生物為特征實施保護的化合物專利)。
(二)屬于國家食品藥品監督管理部門按照《藥品注冊管理辦法(2007版)》注冊分類之一批準上市的下列藥品(監測期內):
1、化學藥品注冊分類的第1.1類(通過合成或者半合成的方法制得的原料藥及其制劑)、1.2類(天然物質中提取或者通過發酵提取的新的有效單體及其制劑);
2.生物制品注冊分類中治療性生物制品的第1類(未在國內外上市銷售的生物制品);
3.中藥和天然藥注冊分類中第1類(未在國內上市銷售的從植物、動物、礦物等物質中提取的有效成份及其制劑)、第2類(新發現的藥材及其制劑)。
以國家食品藥品監督管理部門直接頒發給交易藥品的《國家新藥證書》和《國家注冊批件》為認定依據。
(三)國家依法實施保密的品種。指獲得國家保密局和科學技術部聯合頒發證書的中藥保密處方,中藥保密技術目錄的品種及最新版《中國藥典》中收載的未公開處方藥品。
(四)獲國家食品藥品監督管理部門批準保護的中藥一級保護品種(包括原國務院衛生行政部門批準保護的中藥一級保護品種),以保護期內直接頒發給交易藥品的《中藥保護品種證書》為認定依據。
(五)國家重大新藥創制專項藥品:指獲得國家重大新藥創制科技重大專項項目并在之后獲得國家新藥證書(化學藥1.3、1.4、1.5、2類,中成藥3-5類)或被批準增加新適應癥的藥品(僅指藥品制劑本身)。以國家重大新藥創制科技重大專項實施管理辦公室出具的申報藥品課題立項通知、課題任務合同書、申報藥品通過驗收的驗收結論書及新藥證書等證明材料為認定依據;增加新適應癥的藥品須提供原新藥證書和立項后獲得的注冊批件。文件主送單位是申報生產企業,所列藥品是申報藥品。
二、第二層次
(一)過期專利藥:目前已過保護期的專利藥品(具體解釋見第一層次專利藥品)。過期專利藥企業授權或許可聯合生產的相應藥品(授權人對原廠原料、生產工藝、質量標準及質量一致認可的相關表述,以上四項同時具備)。國家食品藥品監督管理部門公布的質量一致性評價的參比制劑。
(二)出口藥(穩定出口到國際主流市場藥):在我國境內生產,獲美國FDA、歐盟cGMP(英國、法國、德國)、加拿大、澳大利亞TGA、日本JGMP認證,且具體品種劑型連續最近的三個會計年度在上述認證國的出口總額按當年匯率折算累計不低于1000萬元人民幣(中成藥不低于500萬元)的藥品,僅指藥物制劑,不包括原料藥。以同時具備認證證書、認證國進口批文、海關出口退稅證明等材料作為認定依據,屬外文材料的,須附經公證的中文翻譯件。
(三)仿制藥(通過質量一致性評價的仿制藥):通過國家食品藥品監督管理部門質量和療效一致性評價的國產仿制藥品。以國家食品藥品監督管理部門公布的信息為準。
三、第三層次
其他通過GMP認證藥品和其他進口藥品。
注:如某品種同時符合多種競價層次,則按以上先后順序進行劃分。
附件2:市公立醫院藥品集團采購藥品目錄劑型整合規則(征求意見稿)
一、藥品劑型整合
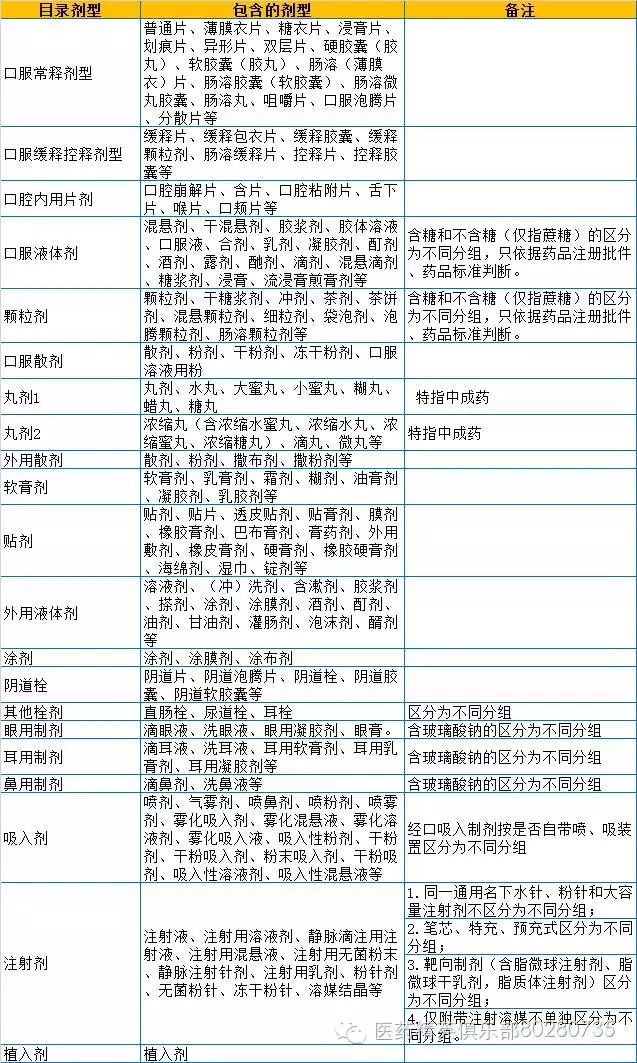
二、其它
1、造影劑含藥量相同濃度不同區分為不同分組。
2.脂肪乳含藥量相同濃度不同區分為不同分組,長鏈、中長鏈脂肪乳區分為不同分組。
3.氨基酸注射液按氨基酸組分不同區分為不同分組。
4.不同亞型品種按藥理效應、臨床用途的不同區分為不同分組。例如:干擾素α-1a、α-2a、α-1b、α-2b、γ等不同亞型區分為不同分組;胸腺肽中胸腺肽α及胸腺肽F區分為不同分組。
5.不同的酸根和鹽基注射劑不區分為不同分組;不同酸根和酯類的口服制劑不區分為不同分組。
6.化學藥品按單方與復方制劑區分為不同分組,但同成分的復方制劑不區分為不同分組(復方制劑中主要成分相同,通用名不同的,不區分為不同分組)。
7.中成藥制劑同名異方的品種按處方組成不同區分為不同分組;同方異名的不區分為不同分組。
8.帶附加裝置(如加藥器、沖洗器)的藥品不區分為不同分組。
9.主要成分含牛黃或麝香的品種,按天然、培植(含體外培育)、人工分為三個不同分組(須有國家相關部門批準證明性文件明確標示)。
10.對兒童用藥單獨區分不同分組。
11.如果藥品采購目錄對劑型有特殊要求將單獨注明。
信息來源:醫藥精英俱樂部
|