【最新】 關(guān)于印發(fā)《2016年度河南省藥品招標(biāo)采購實(shí)施方案》的通知
日期:2016/8/2
河南省醫(yī)藥集中招標(biāo)采購聯(lián)席會(huì)議辦公室
關(guān)于印發(fā)《2016年度河南省藥品招標(biāo)采購實(shí)施方案》的通知
豫藥聯(lián)辦〔2016〕4號(hào)
各省轄市和省直管縣(市)衛(wèi)生計(jì)生委,省直醫(yī)療機(jī)構(gòu),省醫(yī)藥采購服務(wù)中心,有關(guān)藥品生產(chǎn)經(jīng)營(yíng)企業(yè):
《2016年度河南省藥品招標(biāo)采購實(shí)施方案》已經(jīng)河南省醫(yī)藥集中招標(biāo)采購聯(lián)席會(huì)議審議通過,現(xiàn)予以印發(fā),請(qǐng)認(rèn)真貫徹執(zhí)行。
附件:1.名詞解釋
2.經(jīng)濟(jì)技術(shù)標(biāo)書評(píng)審表
2016年7月27日
抄送:河南省人民政府,省醫(yī)藥集中招標(biāo)采購聯(lián)席會(huì)議辦公室各成員單位,河南省公共資源交易中心
2016年度河南省藥品招標(biāo)采購實(shí)施方案
為做好2016年度河南省醫(yī)院藥品招標(biāo)采購工作,根據(jù)《國(guó)務(wù)院辦公廳關(guān)于完善公立醫(yī)院藥品集中采購工作的指導(dǎo)意見》(國(guó)辦發(fā)〔2015〕7號(hào))、《國(guó)務(wù)院辦公廳關(guān)于開展仿制藥質(zhì)量和療效一致性評(píng)價(jià)的意見》(國(guó)辦發(fā)〔2016〕8號(hào))、《國(guó)家衛(wèi)生計(jì)生委關(guān)于落實(shí)完善公立醫(yī)院藥品集中采購工作指導(dǎo)意見的通知》(國(guó)衛(wèi)藥政發(fā)〔2015〕70號(hào))、《河南省人民政府辦公廳關(guān)于印發(fā)河南省公立醫(yī)院藥品集中采購工作實(shí)施辦法的通知》(豫政辦〔2015〕103號(hào))和《河南省人民政府關(guān)于印發(fā)河南省省級(jí)公共資源交易監(jiān)督管理辦法(試行)的通知》(豫政〔2015〕85號(hào)),按照我省深化醫(yī)藥衛(wèi)生體制工作安排,結(jié)合實(shí)際,制定本實(shí)施方案。
一、總體要求
按照市場(chǎng)在資源配置中起決定性作用和更好發(fā)揮政府作用的總要求,借鑒國(guó)際藥品采購?fù)ㄐ凶龇ǎ浞治栈舅幬锊少徑?jīng)驗(yàn),堅(jiān)持以省為單位的網(wǎng)上藥品集中采購方向,實(shí)行一個(gè)平臺(tái)、上下聯(lián)動(dòng)、公開透明、分類采購,采取招生產(chǎn)企業(yè)、招采合一、量?jī)r(jià)掛鉤、雙信封制、全程監(jiān)控等措施,保障醫(yī)院臨床供應(yīng),降低藥品虛高價(jià)格。規(guī)范采購平臺(tái)建設(shè),全面推進(jìn)信息公開,加強(qiáng)藥品采購全過程綜合監(jiān)管,確保公開公平公正。
二、實(shí)施范圍
全省縣級(jí)及以上政府、國(guó)有企業(yè)(含國(guó)有控股企業(yè))等舉辦的公立醫(yī)院、實(shí)施基本藥物制度的基層醫(yī)療衛(wèi)生機(jī)構(gòu)(以下統(tǒng)稱醫(yī)院)必須參加醫(yī)院藥品招標(biāo)采購,使用的所有藥品(不含中藥飲片)均應(yīng)通過河南省藥品集中采購平臺(tái)采購。鼓勵(lì)其他醫(yī)療機(jī)構(gòu)參加醫(yī)院藥品招標(biāo)采購。
參加河南省醫(yī)院藥品招標(biāo)采購活動(dòng)的各方當(dāng)事人適用本方案。
三、工作任務(wù)
(一)制定采購目錄。
根據(jù)全省公立醫(yī)院填報(bào)的藥品采購計(jì)劃,由省醫(yī)藥集中招標(biāo)采購聯(lián)席會(huì)議辦公室確定全省公立醫(yī)院藥品采購目錄。采購目錄包括招標(biāo)采購藥品、談判采購藥品、直接掛網(wǎng)采購藥品、定點(diǎn)生產(chǎn)藥品等藥品。
(二)明確采購方式。
招標(biāo)采購藥品采取公開招標(biāo)采購方式,醫(yī)院作為采購主體,按中標(biāo)價(jià)格采購藥品。談判采購藥品、直接掛網(wǎng)采購藥品、定點(diǎn)生產(chǎn)藥品等藥品的采購管理按照國(guó)家和我省相關(guān)政策規(guī)定執(zhí)行。
對(duì)于直接掛網(wǎng)采購的常用低價(jià)藥品,實(shí)行動(dòng)態(tài)管理。國(guó)家發(fā)展改革委公布的低價(jià)藥品清單之外的其它藥品,如果符合日均費(fèi)用西藥不超過3元、中成藥不超過5元的標(biāo)準(zhǔn),生產(chǎn)企業(yè)可提出申請(qǐng),經(jīng)審核同意后作為低價(jià)藥品管理,實(shí)行直接掛網(wǎng)采購;列入河南省發(fā)展改革委原來公布的低價(jià)藥品清單的藥品,如果日均費(fèi)用突破低價(jià)藥品標(biāo)準(zhǔn)的,生產(chǎn)企業(yè)可提出申請(qǐng),經(jīng)審核同意后可不作為低價(jià)藥品管理,醫(yī)院參考其它同種藥品交易價(jià)格進(jìn)行議價(jià)采購。凡申請(qǐng)進(jìn)入或退出按照低價(jià)藥品管理的藥品,采購周期內(nèi)不得再次變動(dòng)。
采購周期原則上一年一次。
(三)企業(yè)網(wǎng)上報(bào)名。
1.報(bào)名條件。
(1)依法取得有效的藥品生產(chǎn)許可證、GMP證書和營(yíng)業(yè)執(zhí)照。
(2)具有履行合同和藥品供應(yīng)保障能力。
(3)近兩年內(nèi)無生產(chǎn)假劣藥品及其他違法違規(guī)行為。
(4)法律法規(guī)規(guī)定的其它條件。
2.網(wǎng)上報(bào)名和維護(hù)信息。
2015年以前已參加過河南省藥品集中采購的企業(yè)用戶名、密碼不變。新參加的企業(yè),應(yīng)持法人授權(quán)書、藥品生產(chǎn)許可證復(fù)印件、營(yíng)業(yè)執(zhí)照(副本)復(fù)印件,到河南省公共資源交易中心申請(qǐng)領(lǐng)取網(wǎng)上操作用戶名和密碼。
所有報(bào)名企業(yè)均要通過用戶名、密碼登錄河南省藥品集中采購平臺(tái)維護(hù)企業(yè)信息和產(chǎn)品信息。
(四)材料申報(bào)和資質(zhì)審核。
1.申報(bào)的企業(yè)材料。
(1)藥品生產(chǎn)許可證、GMP證書、營(yíng)業(yè)執(zhí)照(副本);
(2)《法人授權(quán)書》;
(3)其它相關(guān)文件材料。
2.申報(bào)的產(chǎn)品材料。
(1)境內(nèi)企業(yè)提供《藥品注冊(cè)批件》,港澳臺(tái)企業(yè)提供《醫(yī)藥產(chǎn)品注冊(cè)證》,國(guó)外企業(yè)提供《進(jìn)口藥品注冊(cè)證》;
(2)產(chǎn)品說明書(原件);
(3)經(jīng)濟(jì)技術(shù)標(biāo)書評(píng)審指標(biāo)相關(guān)證明材料;
(4)境內(nèi)企業(yè)提供藥品最新批次省檢、市檢或廠檢全檢報(bào)告書,港澳臺(tái)及國(guó)外企業(yè)提供經(jīng)國(guó)家食品藥品監(jiān)督管理總局授權(quán)的口岸藥品檢驗(yàn)所出具的進(jìn)口藥品檢驗(yàn)合格證明文件;
(5)境外企業(yè)還需提供其產(chǎn)品國(guó)內(nèi)總代理授權(quán)書(在國(guó)內(nèi)不設(shè)總代理的,只接受一家一級(jí)代理商的報(bào)名,此一級(jí)代理商代理的區(qū)域,須覆蓋河南省轄區(qū)范圍)。
3.申報(bào)材料格式要求。
(1)申報(bào)材料統(tǒng)一使用A4紙張。
(2)申報(bào)材料如為復(fù)印件應(yīng)清晰并逐頁加蓋單位公章。
(3)提交的所有文件材料及往來函電均使用中文,外文材料需提供相應(yīng)的中文翻譯文本。
4.資質(zhì)審核。
在省醫(yī)藥集中招標(biāo)采購聯(lián)席會(huì)議辦公室領(lǐng)導(dǎo)下,由省公共資源交易中心按照有關(guān)規(guī)定組織審核申報(bào)材料。申報(bào)材料如與政府部門網(wǎng)站發(fā)布的信息存在差異,企業(yè)需提供有關(guān)原件進(jìn)行核實(shí)。對(duì)申報(bào)材料中不明確的內(nèi)容,企業(yè)有責(zé)任做出書面解答。
資質(zhì)審核完成后,通過河南省藥品集中采購平臺(tái)公示3天。
(五)投標(biāo)和報(bào)價(jià)。
1.企業(yè)應(yīng)在規(guī)定時(shí)間內(nèi)通過河南省藥品集中采購平臺(tái)進(jìn)行投標(biāo)和報(bào)價(jià),未按規(guī)定操作后果自負(fù)。
2.制定限價(jià)。
以河南省近一年發(fā)生網(wǎng)上交易的藥品采購限價(jià)和最新公布且總體價(jià)格較低的5個(gè)省份中標(biāo)價(jià)格為依據(jù),合理設(shè)定投標(biāo)藥品報(bào)價(jià)的限價(jià)。采購周期內(nèi),中標(biāo)價(jià)格同外省中標(biāo)價(jià)格聯(lián)動(dòng)。
3.報(bào)價(jià)相關(guān)要求。
(1)使用貨幣及單位:人民幣(元),報(bào)價(jià)保留到小數(shù)點(diǎn)后2位(即0.01),如超出小數(shù)點(diǎn)后2位,則四舍五入。
(2)報(bào)價(jià)包裝要求:
小容量口服液體制劑、口服固體制劑按照最小包裝規(guī)格報(bào)價(jià)(如:雙黃連口服液,10ml×10支/盒,按“盒”報(bào)價(jià);羅紅霉素片劑,0.15g×24片/盒,按“盒”報(bào)價(jià)),商務(wù)標(biāo)書按照?qǐng)?bào)價(jià)和包裝數(shù)量折合成單劑量?jī)r(jià)格進(jìn)行評(píng)審, 口服固體制劑中標(biāo)產(chǎn)品按照其單劑量?jī)r(jià)格和數(shù)學(xué)倍數(shù)關(guān)系可適當(dāng)增補(bǔ)部分大包裝。
中成藥及外用制劑中貼膏、貼膜、貼片等以基本包裝報(bào)價(jià)。
注射劑以支(瓶、袋)報(bào)價(jià)。
外用制劑中的乳膠劑、凝膠劑、滴眼液、滴鼻劑、滴耳劑、軟膏劑、眼膏劑、噴霧劑、氣霧劑等以轉(zhuǎn)換系數(shù)報(bào)價(jià)。
(3)藥品的報(bào)價(jià)含配送費(fèi)用。
(六)評(píng)標(biāo)。
招標(biāo)采購藥品同競(jìng)價(jià)組中有3家及以上企業(yè)生產(chǎn)的藥品實(shí)行雙信封制競(jìng)價(jià)采購,投標(biāo)的藥品生產(chǎn)企業(yè)必須同時(shí)編制經(jīng)濟(jì)技術(shù)標(biāo)書和商務(wù)標(biāo)書,通過經(jīng)濟(jì)技術(shù)標(biāo)書評(píng)審的企業(yè)方可進(jìn)入商務(wù)標(biāo)書評(píng)審;同競(jìng)價(jià)組中不足3家企業(yè)生產(chǎn)的藥品,實(shí)行議價(jià)采購。
1.抽取評(píng)標(biāo)專家。
省醫(yī)藥集中招標(biāo)采購聯(lián)席會(huì)議辦公室從河南省藥品集中采購專家?guī)熘邪幢壤S機(jī)抽取參加評(píng)標(biāo)的專家,主要抽取藥學(xué)、臨床醫(yī)學(xué)等人員組成專家委員會(huì);并抽取一定數(shù)量的人員作為候補(bǔ)。與投標(biāo)企業(yè)有利害關(guān)系的專家不得進(jìn)入專家委員會(huì)。
2.劃分競(jìng)價(jià)分組。
從有利競(jìng)爭(zhēng)、滿足需求、確保供應(yīng)出發(fā),區(qū)別藥品不同情況,結(jié)合醫(yī)院用藥特點(diǎn)和質(zhì)量要求,合理設(shè)定競(jìng)價(jià)分組。
A組:國(guó)家一類新藥;獲得國(guó)家技術(shù)發(fā)明獎(jiǎng)或國(guó)家科學(xué)技術(shù)進(jìn)步獎(jiǎng)的藥品;重大新藥創(chuàng)制科技重大專項(xiàng)藥品;國(guó)家保密處方中成藥;中藥一級(jí)保護(hù)品種。
B組:過保護(hù)期專利藥品;通過仿制藥質(zhì)量和療效一致性評(píng)價(jià)的藥品;首次仿(創(chuàng))制藥品;在歐盟、美國(guó)、日本等發(fā)達(dá)國(guó)家(地區(qū))上市銷售的藥品。
C組:保護(hù)期內(nèi)中藥二級(jí)保護(hù)品種;列入工業(yè)和信息化部公布的最新《中國(guó)醫(yī)藥統(tǒng)計(jì)年報(bào)》或是獲得省政府質(zhì)量獎(jiǎng)(省長(zhǎng)質(zhì)量獎(jiǎng))的企業(yè)生產(chǎn)的藥品,同時(shí)為河南省醫(yī)院臨床使用量大的藥品。
D組:其他GMP藥品和其他進(jìn)口藥品。
競(jìng)價(jià)分組相關(guān)名詞解釋見附件1。
3.經(jīng)濟(jì)技術(shù)標(biāo)書評(píng)審。
經(jīng)濟(jì)技術(shù)標(biāo)書主要對(duì)企業(yè)的藥品生產(chǎn)質(zhì)量管理規(guī)范資質(zhì)認(rèn)證、藥品質(zhì)量抽驗(yàn)抽查情況、生產(chǎn)規(guī)模、銷售額、市場(chǎng)信譽(yù)、電子監(jiān)管能力等指標(biāo)進(jìn)行評(píng)審。滿分為100分,其中客觀指標(biāo)分值85分,主觀指標(biāo)分值15分,每項(xiàng)評(píng)價(jià)指標(biāo),分?jǐn)?shù)不累加,得分就高不就低。依據(jù)經(jīng)濟(jì)技術(shù)標(biāo)書評(píng)審結(jié)果合理確定各個(gè)競(jìng)價(jià)組評(píng)審?fù)ㄟ^企業(yè)數(shù)量;如出現(xiàn)得分相同、名次并列入圍的末位產(chǎn)品,則同時(shí)通過。經(jīng)濟(jì)技術(shù)標(biāo)書評(píng)審表見附件2。
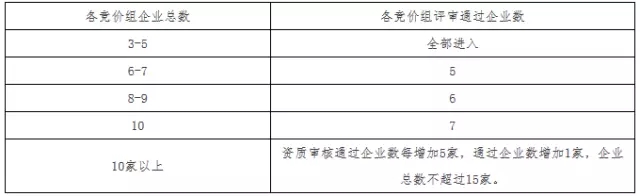
4.商務(wù)標(biāo)書評(píng)審。
進(jìn)入商務(wù)標(biāo)書評(píng)審的企業(yè),同一競(jìng)價(jià)組按照?qǐng)?bào)價(jià)從低到高的排序,第1名、第2名作為擬中標(biāo)企業(yè),第3名作為候選中標(biāo)企業(yè)。報(bào)價(jià)相同的以經(jīng)濟(jì)技術(shù)標(biāo)書得分高優(yōu)先;經(jīng)濟(jì)技術(shù)標(biāo)書得分也相同的,由專家委員會(huì)進(jìn)行票決。
5.價(jià)格評(píng)估。
抽取熟悉藥品市場(chǎng)價(jià)格的專家,按照國(guó)家和我省有關(guān)政策,結(jié)合藥品市場(chǎng)銷售實(shí)際,對(duì)價(jià)格明顯偏低或偏高、可能存在質(zhì)量和供應(yīng)風(fēng)險(xiǎn)的藥品進(jìn)行綜合評(píng)估,避免惡性或不充分競(jìng)爭(zhēng)。
企業(yè)應(yīng)在規(guī)定時(shí)間內(nèi)對(duì)評(píng)估后的價(jià)格進(jìn)行確認(rèn),逾期未確認(rèn)視為自動(dòng)放棄。
(七)公示擬中標(biāo)結(jié)果。
通過河南省藥品集中采購平臺(tái)公示擬中標(biāo)結(jié)果,公示期5天。公示期間接受各方提出的質(zhì)疑。
(八)公布中標(biāo)結(jié)果。
質(zhì)疑處理結(jié)束后,通過河南省藥品集中采購平臺(tái)公布中標(biāo)結(jié)果。
(九)采購與配送。
1.采購管理。
按照國(guó)家和我省藥品采購有關(guān)規(guī)定,結(jié)合臨床需求,醫(yī)院藥物與治療學(xué)委員會(huì)在中標(biāo)藥品目錄和其他掛網(wǎng)藥品目錄內(nèi)遴選本院使用的藥品,并且通過河南省藥品集中采購平臺(tái)進(jìn)行網(wǎng)上采購。
根據(jù)疾病防治需要,確屬臨床必需的藥品,醫(yī)院可提出采購申請(qǐng),經(jīng)審核同意后進(jìn)行掛網(wǎng)限量采購。醫(yī)院要通過河南省藥品集中采購平臺(tái)采購該藥品,參考同種同類藥品中標(biāo)價(jià)格和市場(chǎng)價(jià)格自行與企業(yè)協(xié)商采購價(jià),所有掛網(wǎng)限量采購藥品采購金額不得超過本單位年度藥品采購總金額的5%。
2.簽訂合同。
醫(yī)院要與供貨企業(yè)簽訂藥品采購合同,應(yīng)當(dāng)明確采購品種、劑型、規(guī)格、價(jià)格、數(shù)量、配送批量和時(shí)限、結(jié)算方式和結(jié)算時(shí)間等內(nèi)容,合同約定的采購數(shù)量應(yīng)是本單位采購計(jì)劃的申報(bào)數(shù)量。
3.結(jié)算藥款。
醫(yī)院要將藥品收支納入預(yù)算管理,嚴(yán)格按照合同約定的時(shí)間支付貨款,從交貨驗(yàn)收合格到付款不得超過30天。鼓勵(lì)醫(yī)院與藥品生產(chǎn)企業(yè)直接結(jié)算藥品貨款、藥品生產(chǎn)企業(yè)與配送企業(yè)結(jié)算配送費(fèi)用。鼓勵(lì)醫(yī)院公開招標(biāo)選擇開戶銀行,通過互惠互利、集中開設(shè)銀行賬戶,由銀行提供相應(yīng)藥品周轉(zhuǎn)金服務(wù),加快醫(yī)院付款時(shí)間,降低企業(yè)融資成本和藥品生產(chǎn)流通成本。糾正和防止醫(yī)院以承兌匯票等形式變相拖延回款時(shí)間的現(xiàn)象和行為。
4.配送管理。
(1)藥品生產(chǎn)企業(yè)是保障藥品質(zhì)量和供應(yīng)的第一責(zé)任人。藥品可由中標(biāo)生產(chǎn)企業(yè)直接配送或委托有配送能力的藥品經(jīng)營(yíng)企業(yè)配送到指定醫(yī)院。藥品生產(chǎn)企業(yè)委托的藥品經(jīng)營(yíng)企業(yè)應(yīng)在河南省藥品集中采購平臺(tái)上備案,備案情況向社會(huì)公開。規(guī)范公立醫(yī)院的藥品配送,鼓勵(lì)適度集中,防止形成壟斷。
(2)藥品生產(chǎn)和經(jīng)營(yíng)企業(yè)必須提供合法生產(chǎn)的藥品,并按照購銷合同規(guī)定及時(shí)供貨。必須對(duì)醫(yī)院網(wǎng)上訂單及時(shí)響應(yīng),并通過河南省藥品集中采購平臺(tái)進(jìn)行發(fā)貨確認(rèn),確保急救藥品4小時(shí)內(nèi)配送到位、一般藥品48小時(shí)內(nèi)配送到位,節(jié)假日照常配送。
(十)基層醫(yī)療衛(wèi)生機(jī)構(gòu)藥品使用要求。
實(shí)施基本藥物制度的基層醫(yī)療衛(wèi)生機(jī)構(gòu)必須堅(jiān)持基本藥物主體地位,使用《國(guó)家基本藥物目錄》《河南省基本藥物增補(bǔ)目錄》范圍內(nèi)的藥品和按規(guī)定增加配備使用的非基本藥物,按規(guī)定執(zhí)行網(wǎng)上采購。基層醫(yī)療衛(wèi)生機(jī)構(gòu)要優(yōu)先使用競(jìng)價(jià)分組D組的中標(biāo)藥品和低價(jià)藥品,具體辦法另行制定。
四、工作要求
省醫(yī)藥集中招標(biāo)采購聯(lián)席會(huì)議領(lǐng)導(dǎo)全省藥品集中采購工作,省醫(yī)藥集中招標(biāo)采購聯(lián)席會(huì)議辦公室負(fù)責(zé)組織管理和監(jiān)督檢查,省醫(yī)藥集中招標(biāo)采購聯(lián)席會(huì)議成員單位按照職責(zé)分工,各司其職,密切配合,形成工作合力。省公共資源交易中心受委托具體實(shí)施藥品集中招標(biāo)工作,要健全內(nèi)部制約和外部監(jiān)督機(jī)制,堅(jiān)持用制度管權(quán)管事管人,加強(qiáng)廉潔從業(yè)教育,不斷提高業(yè)務(wù)能力和強(qiáng)化廉潔意識(shí)。
附件1
名 詞 解 釋
一、國(guó)家一類新藥
指《藥品注冊(cè)管理辦法》2007年10月1日頒布實(shí)施后取得新藥證書、生產(chǎn)批件(化學(xué)藥品注冊(cè)分類1.1-1.6小類、中藥、天然藥物注冊(cè)分類1~6類的品種)的藥品。新藥證書有正副本之分的,正本擁有者認(rèn)定為新藥;生產(chǎn)企業(yè)持有副本,科研機(jī)構(gòu)持有正本的,副本持有者認(rèn)定為新藥。無正副本的,以新藥證書持有者為準(zhǔn)。
二、獲得國(guó)家技術(shù)發(fā)明獎(jiǎng)或國(guó)家科學(xué)技術(shù)進(jìn)步獎(jiǎng)的藥品
獲得國(guó)家技術(shù)發(fā)明獎(jiǎng)或國(guó)家科學(xué)技術(shù)進(jìn)步獎(jiǎng)二等獎(jiǎng)以上的藥品。投標(biāo)藥品名稱與獲獎(jiǎng)藥品名稱一致,投標(biāo)生產(chǎn)企業(yè)名稱與獲獎(jiǎng)企業(yè)名稱一致[若為多個(gè)單位獲獎(jiǎng),僅確認(rèn)證書編號(hào)排名第一位(R01或D01)的首要獲獎(jiǎng)單位];如獲獎(jiǎng)?wù)邽閭€(gè)人,僅認(rèn)可獲獎(jiǎng)證書排名首位者且獲獎(jiǎng)證書上標(biāo)注的獲獎(jiǎng)?wù)邌挝粦?yīng)與投標(biāo)生產(chǎn)企業(yè)一致。
三、重大新藥創(chuàng)制科技重大專項(xiàng)藥品
指納入國(guó)家重大新藥創(chuàng)制科技重大專項(xiàng)項(xiàng)目的藥品。以國(guó)家“重大新藥創(chuàng)制”科技重大專項(xiàng)實(shí)施管理辦公室課題立項(xiàng)通知為準(zhǔn)。
四、國(guó)家保密處方中成藥
指獲得科學(xué)技術(shù)部和國(guó)家保密局核發(fā)相關(guān)證書且在保密期內(nèi)的藥品。
五、中藥保護(hù)品種
指獲得國(guó)家食品藥品監(jiān)督管理總局核發(fā)的《中藥保護(hù)品種證書》且在保護(hù)期內(nèi)的藥品。包括中藥保護(hù)一級(jí)、二級(jí)。
六、過保護(hù)期專利藥品
指在原發(fā)明國(guó)/地區(qū)曾經(jīng)取得上述藥品專利證書(包括原研專利授權(quán)聯(lián)合生產(chǎn)的藥品),目前已過保護(hù)期,并且是中國(guó)仿制藥質(zhì)量和療效一致性評(píng)價(jià)參比制劑或國(guó)家發(fā)改委原公布的特定生產(chǎn)企業(yè)的藥品。
七、通過仿制藥質(zhì)量和療效一致性評(píng)價(jià)的藥品
指國(guó)家食品藥品監(jiān)督管理總局對(duì)外公布的通過仿制藥質(zhì)量和療效一致性評(píng)價(jià)的藥品。
八、首次仿(創(chuàng))制藥品
首次仿制藥品指境內(nèi)生產(chǎn)企業(yè)首次仿制國(guó)外專利藥品生產(chǎn)的藥品。
首次創(chuàng)制藥品指境內(nèi)生產(chǎn)企業(yè)中首家自主研發(fā)生產(chǎn)(僅指品種首創(chuàng))的藥品。
企業(yè)需提供省級(jí)食品藥品監(jiān)管部門出具的首仿(創(chuàng))證明(加蓋公章),僅指劑型首仿和品種首創(chuàng)。同一品種、劑型(不區(qū)別規(guī)格)的首仿證明分別有多家企業(yè)提供的,或多家企業(yè)提供同一品種的首創(chuàng)證明(不區(qū)別劑型、規(guī)格)的,以新藥證書頒發(fā)時(shí)間最早的認(rèn)定為首仿(創(chuàng))(投標(biāo)藥品的通用名應(yīng)與新藥證書的藥品名稱一致);均無新藥證書的,以藥品批件頒發(fā)時(shí)間為判定依據(jù),頒發(fā)時(shí)間相同的以編號(hào)排名最前的認(rèn)定為首仿(創(chuàng))。
九、《中國(guó)醫(yī)藥統(tǒng)計(jì)年報(bào)》醫(yī)藥工業(yè)主營(yíng)業(yè)務(wù)收入排序企業(yè)
以工業(yè)和信息化部公布的最新《中國(guó)醫(yī)藥統(tǒng)計(jì)年報(bào)》中的化學(xué)制藥分冊(cè)、中藥生物制藥分冊(cè)所列醫(yī)藥工業(yè)主營(yíng)業(yè)務(wù)收入排序名單為準(zhǔn)。
十、省政府質(zhì)量獎(jiǎng)(省長(zhǎng)質(zhì)量獎(jiǎng))企業(yè)
指獲得省級(jí)人民政府授予的省政府質(zhì)量獎(jiǎng)或省長(zhǎng)質(zhì)量獎(jiǎng)的企業(yè)。
十一、河南省醫(yī)院臨床使用量大的藥品
同通用名、劑型、規(guī)格的藥品中,依據(jù)河南省藥品集中采購平臺(tái)2015年1-11月企業(yè)確認(rèn)配送數(shù)量,除認(rèn)定為A、B組藥品,由大到小排序,累計(jì)占比前50%的藥品。
十二、發(fā)達(dá)國(guó)家(地區(qū))上市銷售的藥品
指在中國(guó)境內(nèi)用同一生產(chǎn)線生產(chǎn)上市并在歐盟、美國(guó)和日本等獲準(zhǔn)上市的藥品,不包括原料藥和車間認(rèn)證。企業(yè)需提供包含認(rèn)證證書、出口報(bào)關(guān)單等相關(guān)材料和聲明,經(jīng)公示無異議。
附件2

信息來源:醫(yī)藥新勢(shì)力
|