【回應(yīng)】海正逐條答復(fù)上交所年報犀利追問
日期:2016/5/19
海正藥業(yè)5月9日收到了上海證券交易所上市公司監(jiān)管一部下發(fā)的《關(guān)于對浙江海正藥業(yè)股份有限公司2015年年度報告的事后審核問詢函》。根據(jù)函件要求,海正藥業(yè)5月17日就相關(guān)事項進行了回復(fù)并披露如下。
年報顯示,2015年海正藥業(yè)實現(xiàn)歸屬于上市公司股東的凈利潤與上年同期相比將下降95.59%,其原因為公司控股子公司原研產(chǎn)品特治星供貨原因?qū)е落N售收入減少、公司部分抗腫瘤類產(chǎn)品銷量下滑及部分原料藥因FDA進口警示而暫時不能進入美國市場導(dǎo)致銷售收入減少以致利潤下降。
就特治星供貨不足事項,請補充披露:
上交所問:結(jié)合以前年度特治星供銷情況,量化分析2015年特治星供貨不足給公司帶來的具體影響;
回復(fù):公司控股子公司海正輝瑞制藥有限公司(以下簡稱“海正輝瑞”)特治星最近三年及一期供銷情況:

2015年原計劃特治星產(chǎn)品營業(yè)收入16億人民幣,因斷貨導(dǎo)致超過15億營業(yè)收入的減少,另由于抗生素銷售隊伍縮編,特治星產(chǎn)品銷售人員減少四分之三,大型學(xué)術(shù)活動減少,對抗生素及其他協(xié)同推廣產(chǎn)品帶來負面影響。
上交所問:結(jié)合2016年一季度特治星的供銷情況,并與供貨不足前進行對比,量化分析目前特治星供銷的恢復(fù)情況;
回復(fù):2016年一季度特治星銷售2.04萬支,此次公司向輝瑞公司再次就特治星供貨問題進行確認,輝瑞公司回復(fù):“輝瑞在解決一些技術(shù)問題以恢復(fù)特治星生產(chǎn)方面繼續(xù)獲得穩(wěn)步進展。恢復(fù)對海正輝瑞合資公司的供貨以滿足中國患者的需求一直是我們的重要工作。我們預(yù)計在未來幾個月里可以恢復(fù)針對中國市場的生產(chǎn),并在2017年早期恢復(fù)特治星在中國市場的供應(yīng)”。海正輝瑞按目前庫存維持醫(yī)院最低供應(yīng),預(yù)計在恢復(fù)正常供貨后:2017年恢復(fù)到歷史最高水平的35%,2018年恢復(fù)到歷史最高水平的70%,2019年恢復(fù)到歷史最高水平。
上交所問:公司已采取何種措施,應(yīng)對特治星供貨不足帶來的影響。
回復(fù):海正輝瑞已采取合理調(diào)配現(xiàn)有庫存,滿足臨床最迫切需要患者的需求,保留最基本的營銷架構(gòu),增加其他產(chǎn)品的營銷工作,通過抗生素產(chǎn)品群繼續(xù)與學(xué)會及醫(yī)院開展學(xué)術(shù)合作。
報告期內(nèi),抗腫瘤藥實現(xiàn)毛利占海正藥品毛利總額的28.61%,毛利貢獻占比較2014年的39.05%有所下降。其中抗腫瘤藥營業(yè)收入減少33.5%,營業(yè)成本增加24.73%。請補充披露:
上交所問:抗腫瘤藥營業(yè)收入減少而營業(yè)成本增加的原因;
回復(fù):2015年海正抗腫瘤制劑表柔比星、伊達比星和吡柔比星由于受海正輝瑞銷售隊伍調(diào)整的影響,造成抗腫瘤制劑銷售大幅下滑,導(dǎo)致抗腫瘤毛利占海正藥品毛利總額較去年同期下降。
上交所問:營業(yè)收入減少所涉的主要抗腫瘤類產(chǎn)品及其銷量下滑的原因;
回復(fù):2015年抗腫瘤藥營收減少而營業(yè)成本增加的原因主要是產(chǎn)品結(jié)構(gòu)發(fā)生變化,由于高毛利的抗腫瘤制劑收入比例下降,而低毛利的抗腫瘤原料增加所致;另由于制劑藥銷量下降而減少原料藥需求也有所下降,導(dǎo)致原料藥成本有所上升。
上交所問:公司對以上抗腫瘤藥銷量下滑的情況,將采用何種措施應(yīng)對。
回復(fù):銷售團隊調(diào)整有利于更好的覆蓋銷售網(wǎng)絡(luò),但2015年銷售團隊調(diào)整對當年的銷售有所影響,從2015年下半年開始,公司銷售架構(gòu)基本穩(wěn)定,2016年一季度海正輝瑞的產(chǎn)品銷售收入較去年同期增長19.87%。
就部分原料藥因FDA進口警示而暫時不能進入美國市場的事項,請補充披露:
上交所問:截至目前,對比2014年,F(xiàn)DA進口警示對公司造成的影響;
回復(fù):公司被列入進口警示的原料藥2014年度在美國市場的銷售收入為19,974萬元,占公司營業(yè)收入比例為1.98%;銷售毛利為11,532萬元,占公司毛利比例為3.41%;影響2015年9-12月份銷售收入7,241萬元,銷售毛利4,744萬元,2016年一季度影響收入5,126萬元,銷售毛利2,240萬元。
上交所問:公司針對FDA進口警示采取的應(yīng)對措施,目前的應(yīng)對效果,以及未來的進一步應(yīng)對計劃。
回復(fù):公司聘請了美國律師,加強與FDA溝通,同時聘請來自美國的、FDA高度認可的第三方顧問公司協(xié)助整改和提高;最近一次第三方公司進行了為期3周的現(xiàn)場GMP審計和數(shù)據(jù)完整性審計,未發(fā)現(xiàn)關(guān)鍵缺陷和數(shù)據(jù)完整性問題。自去年3月FDA檢查后至今,公司已接受國內(nèi)外近80次官方和客戶的檢查,全部順利通過,均無發(fā)現(xiàn)數(shù)據(jù)完整性問題。針對FDA提出的缺陷項,公司逐條開展了調(diào)查和風(fēng)險評估,包括原因分析和質(zhì)量影響分析,并制定了詳細的糾正和預(yù)防措施(CAPA)。
公司從技術(shù)手段、質(zhì)量文化建設(shè)、加強內(nèi)部監(jiān)管和管理等三個方面,有效推進內(nèi)部整改工作:從技術(shù)手段上,制定了QC實驗室計算機系統(tǒng)升級計劃,連接進服務(wù)器或者增加審計追蹤功能,并按升級計劃開展工作;通過IT手段設(shè)置,防止員工對數(shù)據(jù)的刪除。從質(zhì)量文化建設(shè)方面,進行了大量的關(guān)于數(shù)據(jù)完整性、偏差、異常事件處理方面的培訓(xùn);修訂了大量的程序,包括數(shù)據(jù)完整性管理程序、計算機化系統(tǒng)管理程序。加強內(nèi)部監(jiān)管和管理方面,建立第二人對電子數(shù)據(jù)和審計追蹤的復(fù)核制度、主管定期審核制度、派專職QA人員監(jiān)督QC;對歷史數(shù)據(jù)進行回顧,并采取措施。
上交所問:年報顯示,海正藥業(yè)三季度較二季度收入上升,歸屬于上市公司股東的扣除非經(jīng)常性損益后的凈利潤下降。請結(jié)合你公司具體產(chǎn)品的銷售、研發(fā)等情況,補充披露第三季度環(huán)比收入上升而凈利潤下降的原因。
回復(fù):公司第三季度收入較第二季度收入增加4,171萬元,但毛利減少近8,000萬元,同時第三季度銷售費用較第二季度銷售費用增加1.08億,導(dǎo)致第三季度扣非后的凈利潤較第二季度扣非后的凈利潤減少8,400萬元。主要原因如下:(1)公司全資子公司浙江省醫(yī)藥工業(yè)有限公司(以下簡稱“省醫(yī)藥工業(yè)公司”)第三方業(yè)務(wù)(主要是接受制藥企業(yè)或其他醫(yī)藥銷售代理商的委托,向其采購藥品后銷售給浙江省內(nèi)的醫(yī)療機構(gòu)、藥品零售商與批發(fā)商)收入增加1.03億,而毛利總額與二季度接近;(2)毛利率較高的海正輝瑞的輝瑞產(chǎn)品銷售收入減少1.2億,相應(yīng)減少毛利5,820萬元;(3)海正產(chǎn)品的銷售收入雖增加4,874萬元,但增加的是驅(qū)蟲藥等低毛利的原料藥產(chǎn)品,減少的是高毛利率的抗腫瘤制劑等產(chǎn)品,導(dǎo)致毛利總額減少3,293萬元。
上交所問:年報顯示,報告期內(nèi)海正藥業(yè)委托他人投資或管理資產(chǎn)的損益為1799萬元。請補充披露該項收益的具體來源。
回復(fù):報告期內(nèi)公司委托他人投資或管理資產(chǎn)的損益為1,799萬元,其中海正藥業(yè)將閑置的募集資金進行理財?shù)氖找鏋?,128萬元;海正輝瑞和省醫(yī)藥工業(yè)公司利用閑置自有資金購買理財產(chǎn)品收益分別為661萬元和10萬元。
上交所問:年報顯示,報告期內(nèi)海正藥業(yè)非流動資產(chǎn)處置損益約4663萬元。請補充披露非流動資產(chǎn)處置損益產(chǎn)生的具體原因,是否按規(guī)定履行了相應(yīng)的臨時公告義務(wù)。
回復(fù):報告期內(nèi),省醫(yī)藥工業(yè)公司下屬控股子公司浙江云開亞美醫(yī)藥科技股份有限公司(以下簡稱“云開亞美”)通過在臺州市產(chǎn)權(quán)交易所有限公司掛牌引進戰(zhàn)略投資者,其他股東對云開亞美進行增資,導(dǎo)致省醫(yī)藥工業(yè)公司的持股比例由50.60%下降至34.16%,公司喪失對云開亞美的控制權(quán),按稀釋后比例享有增資產(chǎn)生的凈資產(chǎn),因此產(chǎn)生處置收益。同時根據(jù)企業(yè)會計準則的相關(guān)規(guī)定,稀釋后剩余股權(quán)5的公允價值與應(yīng)享有凈資產(chǎn)之間的差額,在合并報表確認為處置收益5,112萬元。另海正藥業(yè)處置(報廢)固定資產(chǎn)的凈損失426.75萬元和海正藥業(yè)(杭州)有限公司(以下簡稱“海正杭州公司”)處置固定資產(chǎn)損失21.73萬元。
云開亞美相關(guān)事項已經(jīng)公司第六屆董事會第二十六次會議審議通過,相關(guān)公告已于2015年9月1日、2015年9月23日、2015年10月30日登載于中國證券報、上海證券報、證券時報和上海證券交易所網(wǎng)站(www.sse.com.cn)上。海正藥業(yè)及海正杭州處置固定資產(chǎn)涉及金額較小,根據(jù)公司章程規(guī)定屬于董事長審核權(quán)限范圍內(nèi),公司已按相關(guān)規(guī)定履行內(nèi)部審核流程。
上交所問:年報顯示,本年應(yīng)收賬款余額為10.75億元,較上年末減少35%。請結(jié)合報告期內(nèi)的產(chǎn)品銷售模式、產(chǎn)品結(jié)構(gòu)等情況補充披露應(yīng)收賬款減少較大的具體原因。
回復(fù):2015年末公司應(yīng)收賬款余額為10.75億元,較年初14.62億元減少了3.87億元,下降35%,主要系公司控股子公司海正輝瑞的應(yīng)收賬款減少所致。海正輝瑞2015年末應(yīng)收賬款余額4.32億,較年初減少3.01億元,銷售賒帳政策沒有變化,但由于海正輝瑞2015年銷售收入較去年同期下降43%,導(dǎo)致應(yīng)收賬款余額較年初下降40%
上交所問:年報顯示,報告期末海正藥業(yè)存貨余額約20億,較期初增加20%。請補充披露公司存貨增加的原因。
回復(fù):報告期內(nèi),公司存貨增加的主要原因:
(1)公司控股子公司海正輝瑞期末存貨余額4.54億,較年初增加1.64億元,主要是2015年末海正輝瑞向外方股東輝瑞公司采購的美卓樂和甲強龍等進口產(chǎn)品在海關(guān)報關(guān)待藥檢而增加庫存所致;
(2)2015年公司部分生產(chǎn)線完工轉(zhuǎn)入生產(chǎn),其中公司子公司海正杭州公司因新生產(chǎn)線投產(chǎn)而增加存貨9,136多萬元;公司全資子公司海正藥業(yè)南通股份有限公司(以下簡稱“海正南通公司”)吡喹酮等生產(chǎn)線投入生產(chǎn)增加存貨2,589萬元。
公司年報顯示,公司在建工程余額達到46億元,占凈資產(chǎn)58%。其中,富陽年產(chǎn)1500萬支注射劑生產(chǎn)項目等多個項目累計投入超出預(yù)算比例較大。請結(jié)合相關(guān)項目的規(guī)劃預(yù)算及決策情況,補充披露:
上交所問:累計投入超出預(yù)算的各項目的名稱、超額金額與比例,以及累計投入大幅超出預(yù)算的具體原因;
回復(fù):截至2015年末,公司累計投入超出預(yù)算的主要項目具體如下:
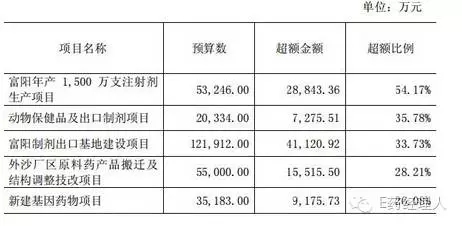
各項目超出預(yù)算的具體原因:
a.富陽年產(chǎn)1,500萬支注射劑生產(chǎn)項目
本項目立項較早,編制預(yù)算時所依據(jù)定額偏低,與項目建設(shè)過程中市場情況(包括建材、設(shè)備、人工費用等)已有較大差距。為符合新版GMP規(guī)范,同時為達到歐美cGMP標準以實現(xiàn)制劑出口的目的,本項目關(guān)鍵設(shè)備如凍干機、自動進出料系統(tǒng)、西林瓶洗烘灌封設(shè)備等均采用進口設(shè)備,根據(jù)抗腫瘤藥物生產(chǎn)的特殊要求,采用成套隔離器等新的設(shè)備,故造成新增設(shè)備投資增加;為實現(xiàn)穩(wěn)定生產(chǎn),特別是滿足無菌注射劑生產(chǎn)條件,本項目配套的空調(diào)、潔凈空氣、制水等公用系統(tǒng)均采用同行業(yè)較高端的設(shè)備,公用系統(tǒng)投入較大;為實現(xiàn)藥品可追溯要求,增加電子標簽設(shè)備;為滿足抗腫瘤凍干和水針制劑的生產(chǎn)需求,本項目提升抗腫瘤注射劑的生產(chǎn)能力,將有效產(chǎn)能增加約300萬支/年,因此生產(chǎn)線投入增加;由于項目建設(shè)周期延長,導(dǎo)致施工過程,外包單位的工程費用增加(含人工、材料等費用)。7以上因素導(dǎo)致本項目的實際投入超出可研預(yù)算金額。
b.動物保健品及出口制劑項目
本項目立項較早,編制預(yù)算時所依據(jù)定額偏低,與項目建設(shè)過程中市場情況(包括建材、設(shè)備、人工費用等)已有較大差距。浙江弘盛藥業(yè)有限公司與海正動保股權(quán)及資產(chǎn)重組后,弘盛藥業(yè)將其原有制劑四、制劑五車間轉(zhuǎn)到海正動保,該生產(chǎn)線按照新版獸藥GMP要求進行升級改造,2個車間改造費用分別為1,472萬元、1,967萬元;為配套廠區(qū)生產(chǎn)的綜合質(zhì)檢研發(fā)樓改造投入增加3,171萬元;由于項目建設(shè)周期延長,導(dǎo)致施工過程,外包單位的工程費用增加(含人工、材料等費用)。以上因素導(dǎo)致本項目的實際投入超出可研預(yù)算金額。
c.富陽制劑出口基地建設(shè)項目
本項目立項較早,編制預(yù)算時所依據(jù)定額偏低,與項目建設(shè)過程中市場情況(包括建材、設(shè)備、人工費用等)已有較大差距。為符合新版GMP規(guī)范,關(guān)鍵生產(chǎn)設(shè)備和公用系統(tǒng)設(shè)備采用較高標準,造成投入增加;本項目部分生產(chǎn)線和資產(chǎn)注入海正輝瑞制藥有限公司,相應(yīng)對項目建設(shè)提高了標準,在項目設(shè)備選型和工藝安裝等方面均作出了技術(shù)調(diào)整;同時注入海正輝瑞的生產(chǎn)線按照2個獨立主體運營的要求,增加獨立的檢測實驗室、增加獨立人流/物流通道和防護設(shè)施、對空調(diào)/新風(fēng)系統(tǒng)等公用設(shè)備進行獨立改造,造成項目投資增加。由于項目建設(shè)周期延長,導(dǎo)致施工過程,外包單位的工程費用增加(含人工、材料等費用)。以上因素導(dǎo)致本項目的實際投入超出可研預(yù)算金額。
d.外沙廠區(qū)原料藥產(chǎn)品搬遷及結(jié)構(gòu)調(diào)整技改項目
本項目立項較早,編制預(yù)算時所依據(jù)定額偏低,與項目建設(shè)過程中市場情況(包括建材、設(shè)備、人工費用等)已有較大差距。為符合新版GMP規(guī)范,關(guān)鍵生產(chǎn)設(shè)備和公用系統(tǒng)設(shè)備采用較高標準,如提取車間引進自動化控制系統(tǒng),造成投入增加;根據(jù)當?shù)蒯t(yī)化園區(qū)轉(zhuǎn)型升級的要求,其中廢水、廢氣整治設(shè)施按照不斷提高的三廢排放標準,多次調(diào)整、完善處理方案,包括增加雨水預(yù)收集池等設(shè)施投入,導(dǎo)致本項目投入大幅增加,其中:廢渣處理車間投入3,718萬、廢氣處理投入2,119萬、污水處理中心投入11,052萬、給排水及消防投入931萬,以上單項投入超出預(yù)算的合計金額約1.48億元;項目建設(shè)周期延長,導(dǎo)致施工過程,外包單位的工程費用增加(含人工、材料等費用)。以上因素導(dǎo)致本項目的實際投入超出可研預(yù)算金額。
e.新建基因藥物項目
本項目立項較早,編制預(yù)算時所依據(jù)定額偏低,與項目建設(shè)過程中市場情況(包括建材、設(shè)備、人工費用等)已有較大差距。根據(jù)生物藥特殊的GMP要求,本項目關(guān)鍵設(shè)備如細胞種子罐、細胞反應(yīng)器、多效蒸餾水機、純蒸汽發(fā)生器、滅菌柜、純化系統(tǒng)等均采用進口設(shè)備,故造成設(shè)備投資較預(yù)期增加;為滿足安佰諾的市場需求,本項目預(yù)留部分廠房用于生物藥原液的擴產(chǎn),預(yù)留部分投入計入本項目;由于項目建設(shè)周期延長,導(dǎo)致施工過程,外包單位的工程費用增加(含人工、材料等費用)。以上因素導(dǎo)致本項目的實際投入超出可研預(yù)算金額。
上交所問:上述相關(guān)項目超預(yù)算投入是否按規(guī)定履行了相應(yīng)的內(nèi)部決策程序和信息披露義務(wù)。請公司年審會計師發(fā)表意見。
回復(fù):公司以上項目在實施過程中,影響投資預(yù)算的因素較多,除了“制劑出口基地項目”、“動物保健品及出口制劑項目”因項目主體變更導(dǎo)致項目實施內(nèi)容進行了部分調(diào)整外,其他項目的建設(shè)內(nèi)容和目標基本符合預(yù)期計劃。
在項目的建設(shè)過程中,為適應(yīng)國內(nèi)外藥品生產(chǎn)法規(guī)不斷提高的要求,達到國家新版GMP標準并符合歐美通行cGMP標準,確保項目建成后盡快通過GMP認證,公司在具體項目建設(shè)過程中,從生產(chǎn)線設(shè)計、廠房建設(shè)、設(shè)備選型、設(shè)備安裝及調(diào)試、配套公用設(shè)施建造等多方面嚴格控制建設(shè)質(zhì)量,造成項目不同環(huán)節(jié)投資超出預(yù)算投資額。
以上涉及項目調(diào)整的審批,已根據(jù)公司相關(guān)規(guī)定均由項目經(jīng)辦人提出申請,依據(jù)工程設(shè)計圖紙、與施工單位/供貨商等單位簽訂的合同等,經(jīng)財務(wù)、投資、工程、裝備、事業(yè)部等相關(guān)部門審核后,報項目負責(zé)人簽字,金額較大的項目報公司總裁/董事長審批。同時公司已在每年的年度報告中披露了各項目的具體投入金額變動情況。
鑒于公司部分項目建設(shè)過程中,存在超預(yù)算較高的情況,公司將進一步加強項目管理,強化對項目管理人員的培訓(xùn),同時在項目立項論證階段,委托具有資質(zhì)的工程咨詢單位在充分考慮項市場環(huán)境和宏觀經(jīng)濟的情況下,合理測算項目的投資預(yù)算。
海正藥業(yè)2013年年報顯示,公司在建工程中富陽年產(chǎn)1500萬支注射劑生產(chǎn)項目、新建基因藥物項目、富陽制劑出口基地建設(shè)項目、外沙廠區(qū)原料藥產(chǎn)品搬遷及結(jié)構(gòu)調(diào)整技改項目工程進度為95%、95%、95%、99%,均處于設(shè)備調(diào)試中。2014年、2015年,上述工程分別共投入21,619萬元、6,146萬元、35,711萬元、11,641萬元,但截至2015年末,上述項目完工進度仍為95%、95%、95%、99%。請補充披露:
上交所問:公司對上述在建工程的規(guī)劃預(yù)算和工程進度安排計劃,中途是否曾發(fā)生變動,以及公司履行的內(nèi)部決策程序和信息披露義務(wù)情況;
回復(fù):(1)公司在年度報告中披露的項目工程進度一般是依據(jù)項目實際建設(shè)進度披露,由于項目存在超支的情況,而工程項目實際并未完工,故富陽年產(chǎn)1500萬支注射劑生產(chǎn)項目等項目的工程進度在歷次年報中增減變動不明顯。由于藥品生產(chǎn)項目(包括原料藥及制劑產(chǎn)品)受嚴格的政策監(jiān)管,生產(chǎn)線建成后一般需要先進行設(shè)備驗證、工藝驗證、穩(wěn)定批生產(chǎn),再申請藥品GMP現(xiàn)場檢查,取得GMP證書后才可進行商業(yè)化生產(chǎn),正式投入使用。故藥品生產(chǎn)建設(shè)項目周期較長(項目主要工程結(jié)束后到通過國內(nèi)GMP認證、取得證書一般需6個月以上)。
隨著新的制藥技術(shù)的應(yīng)用和工程裝備的升級換代,以上項目在實際實施過程中,在滿足設(shè)計基本需求的基礎(chǔ)上,積極應(yīng)用新的工藝技術(shù)和裝備,包括定制的非標設(shè)備。因此,項目的主要建設(shè)內(nèi)容未發(fā)生變化,但在具體的工藝和裝備技術(shù)細節(jié)、以及建設(shè)標準上有一定的提升。部分項目建設(shè)內(nèi)容增加主要系滿足環(huán)保、安全、職業(yè)健康、藥品GMP規(guī)范等要求而增加實施內(nèi)容。
其次,本公司年產(chǎn)1500萬支注射劑項目等項目均包括若干條生產(chǎn)線,在項目的建設(shè)過程中,各生產(chǎn)線是陸續(xù)建成并投產(chǎn)的,因此可能存在部分生產(chǎn)線建設(shè)期限延長,使得項目無法整體竣工投產(chǎn)。如年產(chǎn)1500萬支注射劑項目普通凍干注射劑生產(chǎn)線和抗腫瘤水針生產(chǎn)線已通過GMP認證,但大容量抗腫瘤注射劑生產(chǎn)線設(shè)備安裝尚未完成,仍未投產(chǎn),故該項目建設(shè)進度未達到100%。
以上項目已根據(jù)公司相關(guān)規(guī)定均由項目經(jīng)辦人提出申請,依據(jù)工程設(shè)計圖紙、與施工單位/供貨商等單位簽訂的合同等,經(jīng)財務(wù)、投資、工程、裝備、事業(yè)部等相關(guān)部門審核后,報項目負責(zé)人簽字,金額較大的項目報公司總裁/董事長審批。同時公司已在每年的年度報告中披露了各項目的具體投入金額變動情況。
上交所問:近兩年投入較大,但完工進度沒有變化的具體原因,并說明公司的在建工程是否已及時轉(zhuǎn)入固定資產(chǎn),是否存在媒體報道所稱的“延遲轉(zhuǎn)固,規(guī)避折舊計提,減少利息費用,虛增利潤”等情況。請公司年審會計師發(fā)表意見。
回復(fù):根據(jù)企業(yè)會計準則及相關(guān)規(guī)定,公司從以下幾個方面判斷各在建工程是否已達到預(yù)定可使用狀態(tài):
1)工程項目的實體建造(包括安裝)工作已經(jīng)全部完成或者實質(zhì)上已經(jīng)完成;2)工程項目與設(shè)計要求、合同規(guī)定相符或者基本相符;3)預(yù)計繼續(xù)發(fā)生在所購建的工程項目上的支出金額很少或者幾乎不再發(fā)生;4)醫(yī)藥生產(chǎn)線等項目一般都需要試生產(chǎn),在試生產(chǎn)結(jié)果表明能夠正常生產(chǎn)出合格產(chǎn)品時,認為該醫(yī)藥生產(chǎn)線等項目已經(jīng)達到預(yù)定可使用狀態(tài)。
公司在生產(chǎn)線建造(包括安裝)已經(jīng)完成后,經(jīng)過一定周期的生產(chǎn)工藝驗證,可批量生產(chǎn)出合格產(chǎn)品時,公司據(jù)此判斷在建工程已達到預(yù)定可使用狀態(tài),并及時結(jié)轉(zhuǎn)固定資產(chǎn)。公司及子公司每個在建工程項目包含多條生產(chǎn)線,各條生產(chǎn)線根據(jù)項目規(guī)劃陸續(xù)建造完成,在生產(chǎn)線達到預(yù)定可使用狀態(tài)時結(jié)轉(zhuǎn)固定資產(chǎn)。主要在建工程最近三年的投入和結(jié)轉(zhuǎn)固定資產(chǎn)情況如下:

a.富陽年產(chǎn)1500萬支注射劑項目:其中擴建大容量抗腫瘤生產(chǎn)線和特色劑生產(chǎn)線等正在調(diào)試沒有安裝完畢,其余幾條生產(chǎn)線已通過GMP驗收,并于近幾年結(jié)轉(zhuǎn)固定資產(chǎn)。
b.新建基因藥物項目:總投入4個多億,其中500L子項目已通過GMP驗收,并結(jié)轉(zhuǎn)固定資產(chǎn),另1500L項目等待官方的GMP驗收、擴建微生物表達項目等子項目正在抓緊工程項目掃尾并接受驗收。
c.富陽制劑出口基地建設(shè)項目中培南中試項目和膠塞鋁蓋清洗滅菌項目處于安裝階段,安裝驗收完畢后接受官方GMP驗收后結(jié)轉(zhuǎn)固定資產(chǎn)。
d.外沙廠區(qū)原料藥產(chǎn)品搬遷及結(jié)構(gòu)調(diào)整技改項目:由于泰樂菌素子項目安裝接近完成等待GMP驗收,其他子項目通過GMP驗收,已相應(yīng)結(jié)轉(zhuǎn)固定資產(chǎn)。
以上項目公司已按照企業(yè)會計準則和公司會計政策的規(guī)定及時將在建工程結(jié)轉(zhuǎn)固定資產(chǎn),不存在媒體報道的延遲轉(zhuǎn)固,規(guī)避折舊計提,減少利息費用,虛增利潤”等情況。
公司年報顯示,2015年末海正藥業(yè)在建工程中,富陽基地公用工程、行政管理及培訓(xùn)中心、生物藥公用工程項目、國家戰(zhàn)略性藥品創(chuàng)新及產(chǎn)業(yè)化平臺項目的期末余額分別為2.16億元、1.88億元、1.74億元、7,875.55萬元,但公司未披露這些在建項目的進度狀態(tài)。請補充披露:
上交所問:上述在建項目的規(guī)劃預(yù)算和工程進度安排計劃;
回復(fù):2015年末,公司在建工程中,富陽基地公用工程、行政管理及培訓(xùn)中心、生物藥公用工程項目、國家戰(zhàn)略性藥品創(chuàng)新及產(chǎn)業(yè)化平臺項目的規(guī)劃預(yù)算和工程進度安排計劃如下:
a.富陽基地公用工程
本項目建設(shè)主體為海正藥業(yè)(杭州)有限公司,實施地點在富陽區(qū)胥口鎮(zhèn)。鑒于富陽生產(chǎn)廠區(qū)建設(shè)地點非工業(yè)園區(qū),因此為生產(chǎn)、生活配套設(shè)施等零星工程均需要自行投資建設(shè)。本項目建設(shè)內(nèi)容較多,由若干工程子項目組成,包括:廠區(qū)土地整理、廠區(qū)道路、綠化、鍋爐房、三廢處理中心、倒班宿舍、食堂后勤管理用房、架空管架、道路護坡、排水渠等。
截止2015年底,富陽廠區(qū)大部分公用工程、設(shè)施設(shè)備已正常投入使用。為新建項目配套的水電汽管架、綠化、道路等根據(jù)目前在建項目的施工進度完成配套建設(shè),尚有少量投資需增加。目前富陽廠區(qū)在建重點項目包括:新建二期生物工程項目、口服固體制劑連續(xù)化生產(chǎn)線項目、干粉吸入劑生產(chǎn)線項目以及擴建企業(yè)研究院項目等,新建項目配套三廢處理、廠區(qū)道路、水電汽管架、護坡溝渠及綠化等尚在建,需待以上新建項目竣工后,配套的公用工程再完成建設(shè)。鑒于公用工程包含子工程較多,在正式施工前尚未確定工程量、建設(shè)標準,故公用工程部分投入預(yù)算無法準確預(yù)計。目前配套建設(shè)的公用工程預(yù)計將在2018至2019年陸續(xù)完工。
b.行政管理及培訓(xùn)中心
本項目建設(shè)主體為海正藥業(yè)(杭州)有限公司,實施地點在杭州市富陽區(qū)。
為滿足富陽生產(chǎn)基地的引進人才居住、行政管理、教育培訓(xùn),以及富陽所在地其他子公司的管理需要,配套建設(shè)行政管理和培訓(xùn)中心。本工程包括引進人才宿舍、行政管理中心、培訓(xùn)和會務(wù)中心、子公司省醫(yī)藥公司行政管理和周轉(zhuǎn)庫房、其他零星支出等。本項目房屋土建主體工程已基本完工,即將進行房屋內(nèi)部裝修、購置辦公家具、辦公設(shè)備等。
截止2015年底,累計投入1.72億元,行政管理中心、培訓(xùn)和會務(wù)中心主體廠房已建成,人才宿舍和省公司辦公房/庫房等在建。各工程預(yù)計投資總額合計2.2億元,已累計投入1.72億元,完成進度的78%。預(yù)計2016年12月主要工程基本完工,可投入使用。
c.生物藥公用工程項目
本項目建設(shè)主體為海正藥業(yè)(杭州)有限公司,實施地點在杭州市富陽區(qū)。為滿足富陽基因藥物項目輔助配套相關(guān)公用配套設(shè)施、設(shè)備。本工程主要包括質(zhì)量檢驗、生產(chǎn)小試、潔凈環(huán)境及動力保障系統(tǒng)、外管及管架和污水處理池、道路綠化以及其他零星支出等。本項目各單項工程已基本完工。新建基因藥物項目500L規(guī)模原液生產(chǎn)線的對應(yīng)配套設(shè)施已經(jīng)投入使用。
截止2015年底,累計投入1.74億元,完成預(yù)期進度的98%,其中為500L規(guī)模生產(chǎn)線配套的設(shè)施已投入使用,大規(guī)模產(chǎn)業(yè)化生產(chǎn)線的配套公用系統(tǒng)已基本建成,待生產(chǎn)線通過GMP認證后正式投入生產(chǎn)。預(yù)計2016年內(nèi)投入使用。
d.國家戰(zhàn)略性藥品創(chuàng)新及產(chǎn)業(yè)化平臺項目
本項目建設(shè)主體為公司控股子公司北京軍海藥業(yè)有限責(zé)任公司,實施地點在北京經(jīng)濟技術(shù)開發(fā)區(qū)。
本項目依據(jù)公司五屆八次董事會決議、五屆二十四次董事會決議、2012年度股東大會決議、六屆五次董事會決議,由北京軍海與軍事醫(yī)學(xué)科學(xué)院下屬單位合作共建,原項目為北京凱正生物科技有限公司建設(shè)的“國家應(yīng)急防控藥品研發(fā)和產(chǎn)業(yè)化”項目,由北京軍海與凱正生物合作建設(shè)。2015年下半年,根據(jù)合作各方的約定,項目建設(shè)主體變更為北京軍海,項目土地過戶至北京軍海,故本項目自2015年列入海正合并報表范圍。
2016年根據(jù)項目定位的變化,結(jié)合國家戰(zhàn)略性藥品研發(fā)和儲備需求,經(jīng)海正藥業(yè)六屆二十九次董事會、2015年度股東大會批準,將本項目調(diào)整為“國家戰(zhàn)略性藥品創(chuàng)新及產(chǎn)業(yè)化平臺項目”,總投資增加到6.48億元,項目實施主體和實施地點不變。
截止2015年底,項目累計投入7876萬元,完成投資進度的12%,3幢主體廠房的土建工程已完工,輔助廠房準備土建施工,關(guān)鍵研發(fā)及生產(chǎn)設(shè)備開始招標采購,本項目預(yù)計2018年6月基本完工,投入使用。
上交所問:目前上述在建項目的進度狀態(tài),是否符合預(yù)期。
回復(fù):a.富陽基地公用工程
本項目主要為海正藥業(yè)(杭州)有限公司富陽廠區(qū)生產(chǎn)經(jīng)營配套,各工程建設(shè)進度符合預(yù)期,為前期新建項目順利開工投產(chǎn)提供了必要條件。尚有少量在建公用工程,如新項目周邊道路、管架、三廢處理和溝渠護坡等,依據(jù)主體項目建設(shè)進度要求,預(yù)計在2018年至2019年陸續(xù)建成投入使用,能夠確保新的生產(chǎn)線順利投產(chǎn)。
b.行政管理及培訓(xùn)中心
本項目為海正藥業(yè)(杭州)有限公司富陽廠區(qū)提供配套服務(wù),各項目主體工程已基本完工,預(yù)計2016年底前投入使用。隨著富陽廠區(qū)新生產(chǎn)線的陸續(xù)投產(chǎn),員工隊伍不斷增加,相應(yīng)的辦公、培訓(xùn)和會議需求增長較快。本工程建設(shè)進度基本符合預(yù)期目標,隨著2016年內(nèi)相關(guān)工程投入使用,將進一步改善員工的工作、學(xué)習(xí)條件,并可為子公司省公司擴大經(jīng)營規(guī)模服務(wù)。
c.生物藥公用工程項目
本項目為新建基因藥物項目提供配套,其中500L規(guī)模生產(chǎn)線相關(guān)設(shè)施已投入使用,大規(guī)模產(chǎn)業(yè)化生產(chǎn)線已建成,工程建設(shè)進度符合預(yù)期,待主要生產(chǎn)線通過GMP認證并投產(chǎn)的同時投入使用。
d.國家戰(zhàn)略性藥品創(chuàng)新及產(chǎn)業(yè)化平臺項目
本項目由子公司北京軍海及北京凱正合作共建,計劃在2015年8月將項目轉(zhuǎn)入北京軍海,由北京軍海承繼建設(shè)。2015年8月項目土地使用權(quán)完成過戶,2015年9月項目主體變更至北京軍海。比預(yù)計時間略有延后,主要原因是結(jié)合國家戰(zhàn)略性藥品研發(fā)和儲備需求,項目定位變化,原項目建設(shè)內(nèi)容進行了較大調(diào)整。
經(jīng)海正藥業(yè)2015年度股東大會審議批準,本項目總投資調(diào)整為6.48億元,預(yù)計2018年6月建成投入使用
年報顯示,海正藥業(yè)報告期末開發(fā)支出余額為3.34億元,較期初大幅增加452%。請補充披露:
上交所問:結(jié)合報告期內(nèi)產(chǎn)品研發(fā)進展情況,列出具體研發(fā)項目,并說明開發(fā)支出較往年突然大幅增加的具體原因,是否存在媒體報道所稱的“利用開發(fā)支出調(diào)節(jié)利潤,避免虧損”等情況;
回復(fù):順應(yīng)轉(zhuǎn)型升級的需要,公司加大了對制劑藥、創(chuàng)新藥、生物藥及轉(zhuǎn)移對接項目的研發(fā)投入。2013-2015年度,公司研發(fā)投入的具體情況如下:

報告期末,公司開發(fā)支出科目余額為33,413.20萬元,較2014年末開發(fā)支出6,049.36萬元增加452%,具體情況如下:
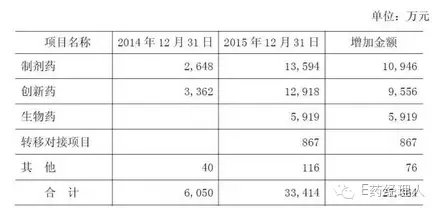
1.制劑藥:2015年制劑藥研發(fā)支出資本化金額較2014年增加10,946萬元,主要原因系公司在布局創(chuàng)新藥和生物藥開發(fā)的同時,也加強仿制藥制劑的開發(fā),公司著眼高端仿制藥,差異化特殊制劑如脂質(zhì)體和白蛋白等藥物開發(fā),涉及品種較多,且公司專業(yè)團隊對每個制劑藥進行評估,對已進入到開發(fā)階段且開發(fā)成功可能性較大的品種進行資本化處理。
2.創(chuàng)新藥:2015年創(chuàng)新藥研發(fā)支出資本化金額較2014年增加9,556萬元,主要原因系2014年公司創(chuàng)新藥HS-25獲批Ⅱ、Ⅲ期臨床批件,公司專業(yè)團隊評估其開發(fā)成功可能性很大,自此公司將其開發(fā)支出計入資本化;2015年公司的新增創(chuàng)新藥AD-35等產(chǎn)品獲批Ⅰ/Ⅱ/Ⅲ期臨床大批件,AD-35立足于多靶點,治標同時兼顧治本,增加療效,減少胃腸道副作用,安全性約為多奈哌齊2-3倍,公司專業(yè)團隊評估其開發(fā)成功可能性很大,已進入到開發(fā)階段,將其開發(fā)支出計入資本化。
3.生物藥:公司較早確立了發(fā)展生物藥的戰(zhàn)略方向,從研發(fā)、生產(chǎn)等方面進行生物藥的布局,2015年公司的首個生物藥重磅產(chǎn)品—安佰諾(融合蛋白)已上市銷售,同時已在開展新興市場的市場營銷工作。2015年生物藥研發(fā)支出資本化金額增加5,919萬元,主要原因系公司以單抗和胰島素類生物藥產(chǎn)品為研發(fā)重點,目前在研產(chǎn)品線達20多個,其中CD20、HER2等產(chǎn)品已進入臨床試驗階段,公司專業(yè)團隊評估其技術(shù)開發(fā)成功或?qū)沓晒D(zhuǎn)入生產(chǎn)可能性非常大,已進入到開發(fā)階段,將其開發(fā)支出計入資本化。
4.轉(zhuǎn)移對接項目:2015年公司轉(zhuǎn)移對接項目的研發(fā)支出資本化金額增加867萬元,主要系公司與陶氏化學(xué)簽署了關(guān)于UK麥角酸等產(chǎn)品的轉(zhuǎn)移生產(chǎn)合同,其在技術(shù)開發(fā)和實現(xiàn)生產(chǎn)的可能性非常大,因此公司將其開發(fā)支出計入資本化。
公司原專注于原料藥領(lǐng)域,近年來公司努力實現(xiàn)由原料藥向制劑升級、從仿制藥向創(chuàng)新藥升級、從化學(xué)藥向生物藥升級的目標,公司研發(fā)也朝著制劑藥、生物藥和創(chuàng)新藥轉(zhuǎn)型,并加大了生物藥和創(chuàng)新藥的研發(fā)投入,然而制劑藥、生物藥和創(chuàng)新藥單個新產(chǎn)品研發(fā)投入遠高于單個原料藥的研發(fā)投入。因此,公司的研發(fā)支出較以往年度增加較為明顯。
上交所問:海正藥業(yè)將內(nèi)部研究開發(fā)項目支出資本化具體時點的政策,并說明在此時點內(nèi)部研發(fā)項目是如何滿足內(nèi)部研發(fā)支出資本化條件的;
回復(fù):根據(jù)企業(yè)會計準則及相關(guān)規(guī)定,公司劃分內(nèi)部研究開發(fā)項目研究階段支出和開發(fā)階段支出的具體標準:
研究階段:公司項目可行性調(diào)查、立項及前期研究開發(fā)作為研究階段。研究階段起點為項目組將項目立項資料提交公司內(nèi)部研究院并審核通過,終點為經(jīng)過前期研究開發(fā)項目可以進入臨床試驗或者進入申報期(已有國家藥品標準的原料藥和制劑)。內(nèi)部研究開發(fā)項目研究階段的支出,在發(fā)生時計入當期損益。
開發(fā)階段:公司臨床試驗和樣品生產(chǎn)申報的階段作為開發(fā)階段。開發(fā)階段的起點為項目可以進入臨床試驗或者進入申報期(已有國家藥品標準的原料藥和制劑),終點為項目取得新藥證書或生產(chǎn)批件。公司進入開發(fā)階段的項目支出,先在“開發(fā)支出”科目分項目進行明細核算,滿足資本化條件的,在項目取得新藥證書或生產(chǎn)批件形成無形資產(chǎn)時轉(zhuǎn)入“無形資產(chǎn)”科目分項目進行明細核算。
公司每個會計年度均要求內(nèi)部研究院整理各項目研發(fā)情況,對于開發(fā)項目研究階段的支出,于發(fā)生時計入當期損益。內(nèi)部研究開發(fā)項目開發(fā)階段的支出,歸集于研發(fā)支出科目,符合條件的予以資本化,不符合資本化條件的計入當期損益。內(nèi)部研究開發(fā)項目開發(fā)階段的支出資本化的條件是:(1)完成該無形資產(chǎn)以使其能夠使用或出售在技術(shù)上具有可行性;(2)具有完成該無形資產(chǎn)并使用或出售的意圖;(3)無形資產(chǎn)產(chǎn)生經(jīng)濟利益的方式,包括能夠證明運用該無形資產(chǎn)生產(chǎn)的產(chǎn)品存在市場或無形資產(chǎn)自身存在市場,無形資產(chǎn)將在內(nèi)部使用的,能證明其有用性;(4)有足夠的技術(shù)、財務(wù)資源和其他資源支持,以完成該無形資產(chǎn)的開發(fā),并有能力使用或出售該無形資產(chǎn);(5)歸屬于該無形資產(chǎn)開發(fā)階段的支出能夠可靠地計量。公司研發(fā)資本化的會計政策未發(fā)生過變化。
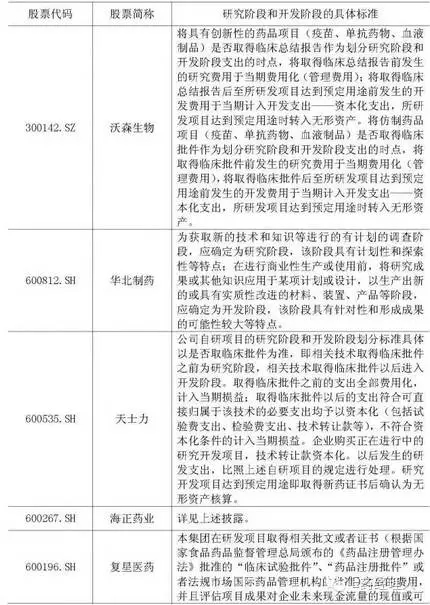
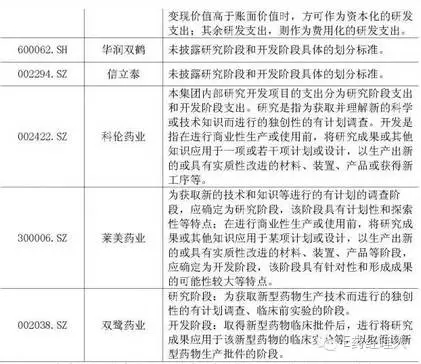
上交所問:請將海正藥業(yè)內(nèi)部開發(fā)支出資本化比率進行同行業(yè)比較,并說明其合理性。請公司年審會計師發(fā)表意見
回復(fù):2015年度同行業(yè)上市公司開發(fā)支出余額前十家公司的資本化研發(fā)投入占研發(fā)投入的比例及相應(yīng)研究階段和開發(fā)階段的具體標準情況如下:

2015年度同行業(yè)上市公司(不含余額為零的公司)開發(fā)支出余額后十家公司的資本化研發(fā)投入占研發(fā)投入的比例及相應(yīng)研究階段和開發(fā)階段的具體標準情況如下:
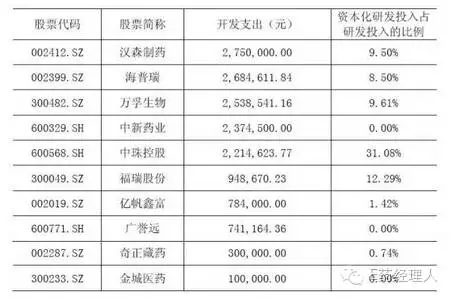
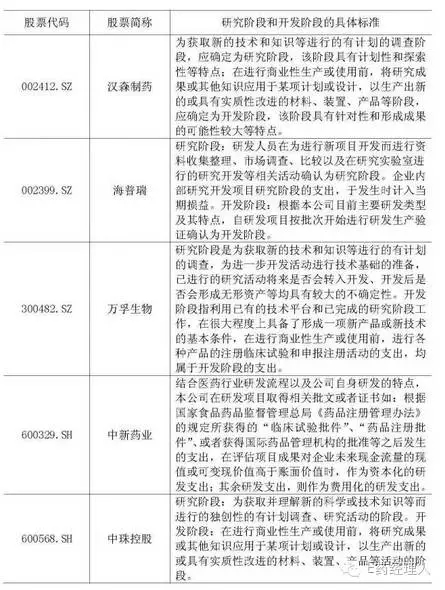
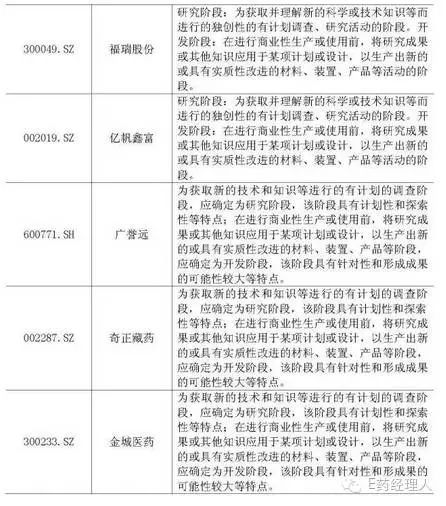
2015年度同行業(yè)上市公司恒瑞醫(yī)藥的資本化研發(fā)投入占研發(fā)投入的比例及相應(yīng)研究階段和開發(fā)階段的具體標準情況如下:
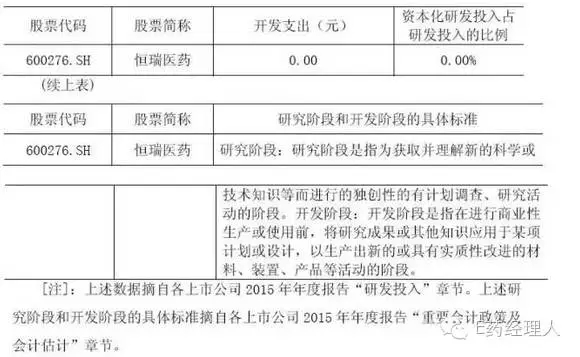
通過與同行業(yè)公司及恒瑞醫(yī)藥相關(guān)政策的比較,同行業(yè)公司界定開發(fā)階段的起點主要分兩類,一是以可以進入臨床或以申報期為起點,二是進行商業(yè)化生產(chǎn)或使用前。
公司以可以進入臨床或申報期作為開發(fā)階段的起點與公司的實際研發(fā)情況相適應(yīng),針對已進入臨床或申報期的研發(fā)項目在經(jīng)過公司專業(yè)團隊的整理和判斷后,將符合內(nèi)部研究開發(fā)項目開發(fā)階段資本化條件的項目進行資本化,相應(yīng)處理符合公司長遠發(fā)展。
結(jié)合上述各上市公司數(shù)據(jù),公司資本化研發(fā)投入占研發(fā)投入的比例在同行業(yè)中處于合理水平,符合公司近年來業(yè)務(wù)轉(zhuǎn)型的實際情況。公司根據(jù)企業(yè)會計準則及相關(guān)規(guī)定劃分內(nèi)部研究開發(fā)項目研究階段支出和開發(fā)階段支出的具體標準,并將符合條件的開發(fā)支出進行資本化,不存在媒體報道所稱的“利用開發(fā)支出調(diào)節(jié)利潤,避免虧損”等情況。
信息來源:E藥經(jīng)理人
|