兩家醫械企業飛檢后遭停產整改!兩家企業GSP證書被撤銷
日期:2016/5/11

5月9日,CFDA官網連續發布《關于汕頭市金豐醫療器械科技有限公司停產整改的通告》(2016年第81號)、《關于南京宏安醫療科技有限公司停產整改的通告》(2016年第82號),以下為通告詳情:
2016年4月,國家食品藥品監督管理總局對汕頭市金豐醫療器械科技有限公司組織了飛行檢查。檢查中,發現該企業質量管理體系主要存在以下缺陷:
一、缺少人員培訓的相關記錄
未能提供產品制造人員具備相應資格或經過針對性的培訓記錄,不符合《醫療器械生產質量管理規范》及相關附錄(以下簡稱《規范》)中要求應當經過與其崗位要求相適應的培訓。
二、生產管理不到位
未制定受控的關鍵和特殊過程的作業指導書,且對關鍵和特殊過程的重要參數未進行驗證或確認,不符合《規范》中要求應當明確關鍵工序和特殊過程,編制相應規程或指導書。
三、質量控制不到位
(一)試管高溫消毒、生產過程真空度檢測等抽驗方法及判定規則描述不清,不符合《規范》中要求按強制性標準以及經注冊或者備案的產品技術要求制定產品的檢驗規程。
(二)采血管容量及采血管泄露檢驗未按產品技術要求的規定執行,不符合《規范》中對產品檢驗的相關要求。
(三)現場未見產品標識及檢驗試驗狀態標識,不符合《規范》中對標識的相關要求。
四、未對質量管理體系的運行進行評價和審核
無定期對產品質量及質量管理工作進行審核、評審和評價的記錄,不符合《規范》要求定期開展管理評審和內審,以確保其持續的適宜性、充分性和有效性。
企業已對上述質量管理體系存在缺陷予以確認。國家食品藥品監督管理總局責成廣東省食品藥品監督管理局責令該企業立即停產整改,對涉及違反《醫療器械監督管理條例》及相關法律法規的,依法嚴肅處理。同時責成廣東省食品藥品監督管理局要求該企業評估產品安全風險,對有可能導致安全隱患的,應當按照《醫療器械召回管理辦法》的規定,召回相關產品。
待企業完成全部項目整改并經所在地省級食品藥品監督管理局跟蹤復查合格后方可恢復生產。
2016年4月,國家食品藥品監督管理總局對南京宏安醫療科技有限公司組織了飛行檢查。檢查中,發現該企業質量管理體系主要存在以下缺陷:
一、部分廠房設施不滿足生產條件
(一)成品、原材料、包裝材料儲存在正修建的鐵皮房中,鐵皮房未封閉,不防水,不符合《醫療器械生產質量管理規范》及相關附錄(以下簡稱《規范》)中要求滿足相應儲存條件的要求。
(二)庫房無溫濕度調控、監測設施,不符合《規范》中要求配備相適應的設施。
(三)無環氧乙烷解析庫,不符合《規范》中要求配備相適應的場所。
(四)用于無菌醫療器械的內包裝材料的生產車間設置在非潔凈區內,不符合《規范》中有關車間的要求。
二、設計開發管理不到位
(一)無法提供完整的產品設計開發文檔,不符合《規范》對文件保存的相關要求。
(二)未保持設計開發更改記錄,不符合《規范》中對更改進行識別并保持紀錄的要求。
三、部分質量控制文件缺失或擅自更改,質量控制不到位
(一)修改后的產品出廠檢驗規程與技術要求規定不一致,且不符合YY0338.1—2002的規定,不符合《規范》中要求按強制性標準以及經注冊或者備案的產品技術要求制定產品的檢驗規程。
(二)未制定產品放行程序,未明確放行程度、條件和放行標準,不符合《規范》中對產品檢驗的相關要求。
(三)未按規定方法進行無菌檢驗,不符合《規范》中對產品檢驗的相關要求。
四、不合格品控制不到位
不合格(報廢)的透析紙與合格的透析紙混放,未進行標識、記錄、隔離、評審,不符合《規范》中對不合格品識別、控制的要求。
企業已對上述質量管理體系存在缺陷予以確認。國家食品藥品監督管理總局責成江蘇省食品藥品監督管理局責令該企業立即停產整改,對涉及違反《醫療器械監督管理條例》及相關法律法規的,依法嚴肅處理。同時責成江蘇省食品藥品監督管理局要求該企業評估產品安全風險,對有可能導致安全隱患的,應當按照《醫療器械召回管理辦法》的規定,召回相關產品。
待企業完成全部項目整改并經所在地省級食品藥品監督管理局跟蹤復查合格后方可恢復生產。
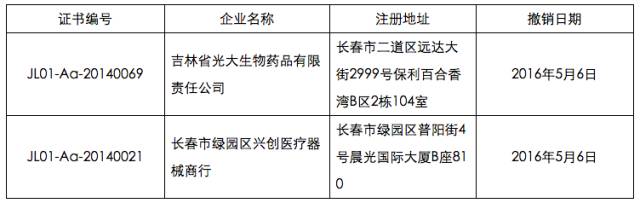
此外,5月6日,吉林省食品藥品監督管理局發布《關于撤銷吉林省光大生物藥品有限責任公司等2家企業GSP認證證書的公告》(2016年第10號)。公告稱,吉林省光大生物藥品有限責任公司、長春市綠園區興創醫療器械商行嚴重違反《藥品經營質量管理規范》規定,依據《藥品經營質量管理規范認證管理辦法》第四十五條及國家食品藥品監督管理總局《關于嚴格執行<藥品經營質量管理規范>加強藥品批發企業監督檢查工作的通知》(食藥監藥化監〔2015〕85號)規定,依法撤銷其《藥品經營質量管理規范認證證書》,現予以公布。
信息來源:醫藥經濟報
|