近兩年,醫(yī)藥行業(yè)新政新規(guī)連發(fā),資本動作頻頻,投資并購“危”“機”并存,醫(yī)藥企業(yè)應(yīng)如何避險、轉(zhuǎn)型、升級?資深醫(yī)藥并購專家、神威藥業(yè)集團前副總裁張自然博士憑借26年來深耕國內(nèi)外醫(yī)藥行業(yè)的經(jīng)驗,梳理總結(jié)了2015年以來我國醫(yī)藥健康行業(yè)的新政策法規(guī)并做解讀,供醫(yī)藥企業(yè)同行借鑒。以下為其在“2016第二屆中國醫(yī)藥健康產(chǎn)業(yè)投資并購年會”上的演講紀(jì)要:

2015年以來,發(fā)布的政策法規(guī)主要圍繞質(zhì)量、創(chuàng)新、控費、中醫(yī)藥這四大核心主題,其目的在于深化醫(yī)改,也就是要解決看病難、看病貴和醫(yī)保透支的問題,而改革的進程卻呈現(xiàn)出由醫(yī)改到藥改再控費,最后寄厚望于中醫(yī)藥(甘肅模式)的格局,就制藥工業(yè)而言,化藥向前看(國際化),中藥向后望(重在傳承)成為必然選擇。
2015年以來的政策法規(guī)呈現(xiàn)出如下特點:“多”(文件數(shù)量多)、“高”(發(fā)文機關(guān)級別高,動輒國務(wù)院)、“長”(時間跨度長)。
| 1、2015年以來文件歸類
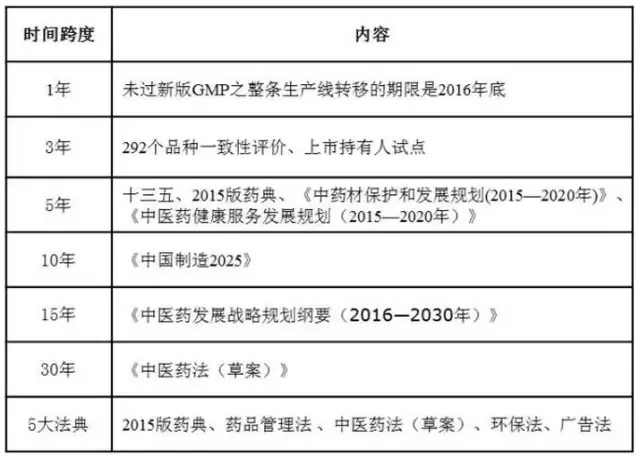
(1)按政策法規(guī)顯效的時間跨度分

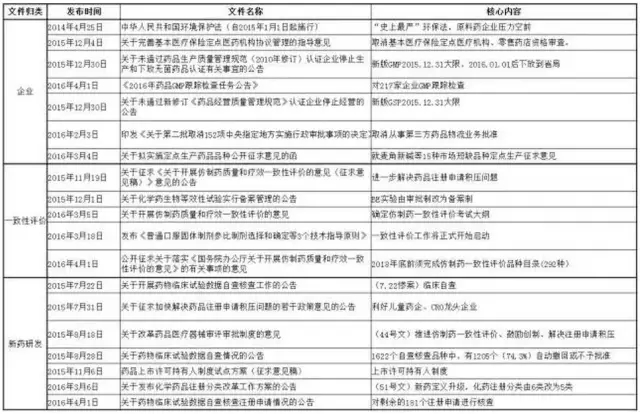
(2)按文件發(fā)力的產(chǎn)業(yè)鏈上的不同環(huán)節(jié)分

| 2、2015年以來的政策有收有放

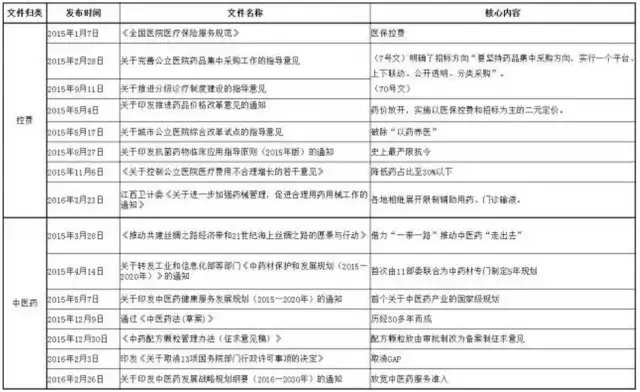
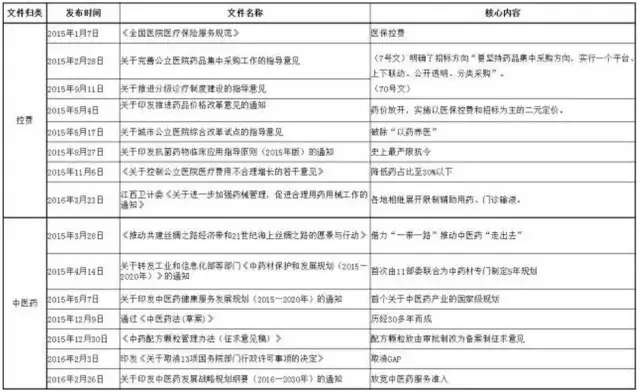
| 3、2015年以來重點文件歸類匯總


| 4、2015年重點文件解讀
(1)GMP
相關(guān)統(tǒng)計顯示,截止2016年3月28日,共有2836家制劑生產(chǎn)企業(yè)未通過GMP。2016年4月1日,CFDA發(fā)文,2016年將對217家GMP跟蹤檢查,僅2015年就收回140張GMP證書,所以,即使通過的新版GMP認(rèn)證,也必須在今后的生產(chǎn)過程中堅持按GMP規(guī)范操作,否則將難逃飛檢大關(guān),隨著MAH制度的推進,過剩的藥品制造產(chǎn)能將大幅被淘汰。
未通過新版GMP認(rèn)證的企業(yè)中,其獨家品種即有739個,兩家同時擁有的品種有301個,整條生產(chǎn)線轉(zhuǎn)移的期限是2016年底。
截至2015年12月31日,CFDA官網(wǎng)藥品數(shù)據(jù)庫中已有115家藥品生產(chǎn)企業(yè)關(guān)門(注銷或吊銷),涉及藥品批準(zhǔn)文號885個。
(2)一致性評價
化學(xué)藥品新注冊分類實施前批準(zhǔn)上市的仿制藥,包括國產(chǎn)仿制藥、進口仿制藥和原研藥品地產(chǎn)化品種,均須開展一致性評價。
通過一致性評價的批文則保留,不通過的則不予再注冊而死掉;
同一品種,首家通過一致性評價后,其他廠家需在3年內(nèi)完成評價,否則不得上市;
通過一致性評價的,在醫(yī)院優(yōu)先使用,招標(biāo)、醫(yī)保報銷等環(huán)節(jié)也將獲得優(yōu)待;
首批292個品種須于2018.12.31前完成一致性評價,其中含444個規(guī)格,涉及17000余文號,近2000家藥企(包括內(nèi)資、外資),近80家上市公司。
一致性評價是企業(yè)調(diào)整處方、調(diào)整工藝的機會。
在開展藥品上市許可持有人制度的試點區(qū)域,可以通過一致性評價拿下屬于自己的品種了。
(3)“國際化”藥企重大利好
“國內(nèi)藥品生產(chǎn)企業(yè)已在歐盟、美國和日本獲準(zhǔn)上市的仿制藥,按照《關(guān)于發(fā)布化學(xué)藥品注冊分類改革工作方案的公告》(2016年第51號)的有關(guān)要求申報仿制藥注冊申請,由藥審中心審評,批準(zhǔn)上市后視為通過一致性評價。”
“國內(nèi)藥品生產(chǎn)企業(yè)已在歐盟、美國和日本獲準(zhǔn)上市的仿制藥,可以國外注冊申報的相關(guān)資料為基礎(chǔ),按照化學(xué)藥品新注冊分類申報藥品上市,批準(zhǔn)上市后視同通過一致性評價;在中國境內(nèi)用同一生產(chǎn)線生產(chǎn)上市并在歐盟、美國和日本獲準(zhǔn)上市的藥品,視同通過一致性評價。”
據(jù)監(jiān)測,僅2015年,至少3000多個藥品批準(zhǔn)文號通過技術(shù)轉(zhuǎn)移、生產(chǎn)線轉(zhuǎn)移等方式落戶新家。
(4)中醫(yī)藥
借力“一帶一路”推動中醫(yī)藥“走出去”
1)習(xí)近平主席于2013年9月和12月,分別見證了中國-吉爾吉斯斯坦、中國-烏克蘭中醫(yī)藥領(lǐng)域合作諒解備忘錄的簽署,進一步為中醫(yī)藥參與‘一帶一路’建設(shè)指明了方向。
2)2015年6月中捷中醫(yī)中心的成立,成為我國實施中醫(yī)藥“一帶一路”戰(zhàn)略以來首個健康領(lǐng)域合作項目。2016年3月29日習(xí)近平主席親臨視察。
3)繼高鐵、核電、特高壓之后,中醫(yī)藥產(chǎn)業(yè)有望成為中國在國際上新的產(chǎn)業(yè)名片。
4)截至2014年底,國家中醫(yī)藥管理局已經(jīng)與外國政府、地區(qū)組織簽訂了83個中醫(yī)藥領(lǐng)域合作協(xié)議,這些協(xié)議的簽署國(地區(qū))絕大多數(shù)分布在“一帶一路”沿線。僅2013年,“一帶一路”沿線國家中藥類商品進出口總額就達(dá)到近20.8億美元,占我國中藥類商品進出口額的50%以上。作為“一帶一路”經(jīng)濟走廊的源頭,新疆、甘肅、云南、廣西、福建等地的醫(yī)、教、研、產(chǎn)機構(gòu)都與64個國家開展了中醫(yī)藥交流合作,并取得了許多成果。
中醫(yī)藥發(fā)展戰(zhàn)略規(guī)劃綱要(2016—2030年)
切實提高中醫(yī)藥服務(wù)能力,完善覆蓋城鄉(xiāng)的中醫(yī)醫(yī)療服務(wù)網(wǎng)絡(luò)。
大力發(fā)展中醫(yī)養(yǎng)生保健服務(wù),加強中醫(yī)養(yǎng)生保健服務(wù)體系和能力建設(shè)。
扎實推進中醫(yī)藥繼承,加強中醫(yī)藥傳統(tǒng)知識保護和技術(shù)挖掘,強化中醫(yī)師承教育。
著力推進中醫(yī)藥創(chuàng)新,加強中醫(yī)藥理論創(chuàng)新,重大疑難疾病攻關(guān)和重大新藥創(chuàng)制,健全中醫(yī)藥協(xié)同創(chuàng)新體系。
全面提升中醫(yī)藥產(chǎn)業(yè)水平,加強中藥資源保護利用。
大力弘揚中醫(yī)藥文化。
積極推動中醫(yī)藥海外發(fā)展,加強中醫(yī)藥對外交流合作。
《中醫(yī)藥法(草案)》擬著重解決如下問題
中醫(yī)藥特色與優(yōu)勢淡化
服務(wù)領(lǐng)域趨于萎縮
中醫(yī)藥理論和技術(shù)方法創(chuàng)新不足
中醫(yī)藥人才匱乏
具體為:
1)院內(nèi)制劑由許可管理改為備案管理
2)師承也可獲醫(yī)師資格
3)徹底終結(jié)“以西范中”
中藥配方顆粒
到2016年市場整體規(guī)模有望突破110億元,但中藥配方顆粒在我國中成藥市場中的占比尚不足2%,有巨大的提升空間。天江藥業(yè)營收從2001年的5700萬元,增長至2013年的25億元。北京康仁堂銷售額從2008年的300萬元快速增長到2015年的18億元,連年實現(xiàn)40%的增長率。
目前國內(nèi)已有1072家企業(yè)獲得顆粒劑生產(chǎn)的GMP證書,擁有中藥提取的GMP證書有917家企業(yè),同時擁有提取和顆粒劑GMP的生產(chǎn)廠家有628家。
放開征求意見已于2016.03.31結(jié)束,目前的核心問題是標(biāo)準(zhǔn)問題。
尚有優(yōu)質(zhì)的中華老字號尚待發(fā)揮其文化傳播價值。
中藥保護品種
截至2015年11月25日,我國尚在保護期內(nèi)的中藥保護品種證書共342件,分布于277個品種(精確到劑型)、261家生產(chǎn)企業(yè),目前所有在保護期內(nèi)的中藥保護品種均為二級保護。據(jù)了解,云南白藥及膠囊20年保護期已過,正在續(xù)批10年保護期;阿膠、龍牡壯骨顆粒、片仔癀和六神丸10年保護期已過,在續(xù)批7年保護期。短短的幾年時間,剩下的中藥保護品種只有2009年五分之一左右,保護期延長數(shù)量也大大減少,只有20%。預(yù)計中藥保護品種的審批雖然不會取消,但是數(shù)量將進一步減少,門檻也會大大提高,能夠成為中藥保護品種的必將是真正有優(yōu)異的臨床療效的品種。
(5)規(guī)劃
關(guān)于促進醫(yī)藥產(chǎn)業(yè)健康發(fā)展的指導(dǎo)意見
目標(biāo):在2020 年時90%以上重大專利到期藥物實現(xiàn)仿制上市,主營業(yè)務(wù)增速高于10%;
重創(chuàng)新:加強原研藥、首仿藥、中藥、新劑型研究;
調(diào)結(jié)構(gòu);
嚴(yán)規(guī)范:加快質(zhì)量升級;
促升級。
十三五”規(guī)劃
創(chuàng)新打開市場空間;
中醫(yī)藥迎來發(fā)展動能;
高性能器械、IVD前景廣闊;
精準(zhǔn)醫(yī)療新增長點;
開放醫(yī)療、商貿(mào)物流領(lǐng)域。
中國制造2025
發(fā)展針對重大疾病的化學(xué)藥、中藥、生物技術(shù)藥物新產(chǎn)品,重點包括新機制和新靶點化學(xué)藥、抗體藥物、抗體偶聯(lián)藥物、全新結(jié)構(gòu)蛋白及多肽藥物、新型疫苗、臨床優(yōu)勢突出的創(chuàng)新中藥及個性化治療藥物。
提高醫(yī)療器械的創(chuàng)新能力和產(chǎn)業(yè)化水平,重點發(fā)展影像設(shè)備、醫(yī)用機器人等高性能診療設(shè)備,全降解血管支架等高值醫(yī)用耗材,可穿戴、遠(yuǎn)程診療等移動醫(yī)療產(chǎn)品。
實現(xiàn)生物3D打印、誘導(dǎo)多能干細(xì)胞等新技術(shù)的突破和應(yīng)用。
近兩年,醫(yī)藥行業(yè)新政新規(guī)連發(fā),資本動作頻頻,投資并購“危”“機”并存,醫(yī)藥企業(yè)應(yīng)如何避險、轉(zhuǎn)型、升級?資深醫(yī)藥并購專家、神威藥業(yè)集團前副總裁張自然博士憑借26年來深耕國內(nèi)外醫(yī)藥行業(yè)的經(jīng)驗,梳理總結(jié)了2015年以來我國醫(yī)藥健康行業(yè)的新政策法規(guī)并做解讀,供醫(yī)藥企業(yè)同行借鑒。以下為其在“2016第二屆中國醫(yī)藥健康產(chǎn)業(yè)投資并購年會”上的演講紀(jì)要:

2015年以來,發(fā)布的政策法規(guī)主要圍繞質(zhì)量、創(chuàng)新、控費、中醫(yī)藥這四大核心主題,其目的在于深化醫(yī)改,也就是要解決看病難、看病貴和醫(yī)保透支的問題,而改革的進程卻呈現(xiàn)出由醫(yī)改到藥改再控費,最后寄厚望于中醫(yī)藥(甘肅模式)的格局,就制藥工業(yè)而言,化藥向前看(國際化),中藥向后望(重在傳承)成為必然選擇。
2015年以來的政策法規(guī)呈現(xiàn)出如下特點:“多”(文件數(shù)量多)、“高”(發(fā)文機關(guān)級別高,動輒國務(wù)院)、“長”(時間跨度長)。
| 1、2015年以來文件歸類
(1)按政策法規(guī)顯效的時間跨度分
(2)按文件發(fā)力的產(chǎn)業(yè)鏈上的不同環(huán)節(jié)分

| 2、2015年以來的政策有收有放

| 3、2015年以來重點文件歸類匯總
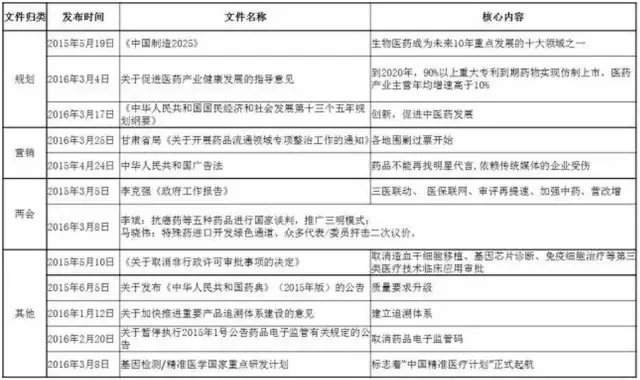
| 4、2015年重點文件解讀
(1)GMP
相關(guān)統(tǒng)計顯示,截止2016年3月28日,共有2836家制劑生產(chǎn)企業(yè)未通過GMP。2016年4月1日,CFDA發(fā)文,2016年將對217家GMP跟蹤檢查,僅2015年就收回140張GMP證書,所以,即使通過的新版GMP認(rèn)證,也必須在今后的生產(chǎn)過程中堅持按GMP規(guī)范操作,否則將難逃飛檢大關(guān),隨著MAH制度的推進,過剩的藥品制造產(chǎn)能將大幅被淘汰。
未通過新版GMP認(rèn)證的企業(yè)中,其獨家品種即有739個,兩家同時擁有的品種有301個,整條生產(chǎn)線轉(zhuǎn)移的期限是2016年底。
截至2015年12月31日,CFDA官網(wǎng)藥品數(shù)據(jù)庫中已有115家藥品生產(chǎn)企業(yè)關(guān)門(注銷或吊銷),涉及藥品批準(zhǔn)文號885個。
(2)一致性評價
化學(xué)藥品新注冊分類實施前批準(zhǔn)上市的仿制藥,包括國產(chǎn)仿制藥、進口仿制藥和原研藥品地產(chǎn)化品種,均須開展一致性評價。
通過一致性評價的批文則保留,不通過的則不予再注冊而死掉;
同一品種,首家通過一致性評價后,其他廠家需在3年內(nèi)完成評價,否則不得上市;
通過一致性評價的,在醫(yī)院優(yōu)先使用,招標(biāo)、醫(yī)保報銷等環(huán)節(jié)也將獲得優(yōu)待;
首批292個品種須于2018.12.31前完成一致性評價,其中含444個規(guī)格,涉及17000余文號,近2000家藥企(包括內(nèi)資、外資),近80家上市公司。
一致性評價是企業(yè)調(diào)整處方、調(diào)整工藝的機會。
在開展藥品上市許可持有人制度的試點區(qū)域,可以通過一致性評價拿下屬于自己的品種了。
(3)“國際化”藥企重大利好
“國內(nèi)藥品生產(chǎn)企業(yè)已在歐盟、美國和日本獲準(zhǔn)上市的仿制藥,按照《關(guān)于發(fā)布化學(xué)藥品注冊分類改革工作方案的公告》(2016年第51號)的有關(guān)要求申報仿制藥注冊申請,由藥審中心審評,批準(zhǔn)上市后視為通過一致性評價。”
“國內(nèi)藥品生產(chǎn)企業(yè)已在歐盟、美國和日本獲準(zhǔn)上市的仿制藥,可以國外注冊申報的相關(guān)資料為基礎(chǔ),按照化學(xué)藥品新注冊分類申報藥品上市,批準(zhǔn)上市后視同通過一致性評價;在中國境內(nèi)用同一生產(chǎn)線生產(chǎn)上市并在歐盟、美國和日本獲準(zhǔn)上市的藥品,視同通過一致性評價。”
據(jù)監(jiān)測,僅2015年,至少3000多個藥品批準(zhǔn)文號通過技術(shù)轉(zhuǎn)移、生產(chǎn)線轉(zhuǎn)移等方式落戶新家。
(4)中醫(yī)藥
借力“一帶一路”推動中醫(yī)藥“走出去”
1)習(xí)近平主席于2013年9月和12月,分別見證了中國-吉爾吉斯斯坦、中國-烏克蘭中醫(yī)藥領(lǐng)域合作諒解備忘錄的簽署,進一步為中醫(yī)藥參與‘一帶一路’建設(shè)指明了方向。
2)2015年6月中捷中醫(yī)中心的成立,成為我國實施中醫(yī)藥“一帶一路”戰(zhàn)略以來首個健康領(lǐng)域合作項目。2016年3月29日習(xí)近平主席親臨視察。
3)繼高鐵、核電、特高壓之后,中醫(yī)藥產(chǎn)業(yè)有望成為中國在國際上新的產(chǎn)業(yè)名片。
4)截至2014年底,國家中醫(yī)藥管理局已經(jīng)與外國政府、地區(qū)組織簽訂了83個中醫(yī)藥領(lǐng)域合作協(xié)議,這些協(xié)議的簽署國(地區(qū))絕大多數(shù)分布在“一帶一路”沿線。僅2013年,“一帶一路”沿線國家中藥類商品進出口總額就達(dá)到近20.8億美元,占我國中藥類商品進出口額的50%以上。作為“一帶一路”經(jīng)濟走廊的源頭,新疆、甘肅、云南、廣西、福建等地的醫(yī)、教、研、產(chǎn)機構(gòu)都與64個國家開展了中醫(yī)藥交流合作,并取得了許多成果。
中醫(yī)藥發(fā)展戰(zhàn)略規(guī)劃綱要(2016—2030年)
切實提高中醫(yī)藥服務(wù)能力,完善覆蓋城鄉(xiāng)的中醫(yī)醫(yī)療服務(wù)網(wǎng)絡(luò)。
大力發(fā)展中醫(yī)養(yǎng)生保健服務(wù),加強中醫(yī)養(yǎng)生保健服務(wù)體系和能力建設(shè)。
扎實推進中醫(yī)藥繼承,加強中醫(yī)藥傳統(tǒng)知識保護和技術(shù)挖掘,強化中醫(yī)師承教育。
著力推進中醫(yī)藥創(chuàng)新,加強中醫(yī)藥理論創(chuàng)新,重大疑難疾病攻關(guān)和重大新藥創(chuàng)制,健全中醫(yī)藥協(xié)同創(chuàng)新體系。
全面提升中醫(yī)藥產(chǎn)業(yè)水平,加強中藥資源保護利用。
大力弘揚中醫(yī)藥文化。
積極推動中醫(yī)藥海外發(fā)展,加強中醫(yī)藥對外交流合作。
《中醫(yī)藥法(草案)》擬著重解決如下問題
中醫(yī)藥特色與優(yōu)勢淡化
服務(wù)領(lǐng)域趨于萎縮
中醫(yī)藥理論和技術(shù)方法創(chuàng)新不足
中醫(yī)藥人才匱乏
具體為:
1)院內(nèi)制劑由許可管理改為備案管理
2)師承也可獲醫(yī)師資格
3)徹底終結(jié)“以西范中”
中藥配方顆粒
到2016年市場整體規(guī)模有望突破110億元,但中藥配方顆粒在我國中成藥市場中的占比尚不足2%,有巨大的提升空間。天江藥業(yè)營收從2001年的5700萬元,增長至2013年的25億元。北京康仁堂銷售額從2008年的300萬元快速增長到2015年的18億元,連年實現(xiàn)40%的增長率。
目前國內(nèi)已有1072家企業(yè)獲得顆粒劑生產(chǎn)的GMP證書,擁有中藥提取的GMP證書有917家企業(yè),同時擁有提取和顆粒劑GMP的生產(chǎn)廠家有628家。
放開征求意見已于2016.03.31結(jié)束,目前的核心問題是標(biāo)準(zhǔn)問題。
尚有優(yōu)質(zhì)的中華老字號尚待發(fā)揮其文化傳播價值。
中藥保護品種
截至2015年11月25日,我國尚在保護期內(nèi)的中藥保護品種證書共342件,分布于277個品種(精確到劑型)、261家生產(chǎn)企業(yè),目前所有在保護期內(nèi)的中藥保護品種均為二級保護。據(jù)了解,云南白藥及膠囊20年保護期已過,正在續(xù)批10年保護期;阿膠、龍牡壯骨顆粒、片仔癀和六神丸10年保護期已過,在續(xù)批7年保護期。短短的幾年時間,剩下的中藥保護品種只有2009年五分之一左右,保護期延長數(shù)量也大大減少,只有20%。預(yù)計中藥保護品種的審批雖然不會取消,但是數(shù)量將進一步減少,門檻也會大大提高,能夠成為中藥保護品種的必將是真正有優(yōu)異的臨床療效的品種。
(5)規(guī)劃
關(guān)于促進醫(yī)藥產(chǎn)業(yè)健康發(fā)展的指導(dǎo)意見
目標(biāo):在2020 年時90%以上重大專利到期藥物實現(xiàn)仿制上市,主營業(yè)務(wù)增速高于10%;
重創(chuàng)新:加強原研藥、首仿藥、中藥、新劑型研究;
調(diào)結(jié)構(gòu);
嚴(yán)規(guī)范:加快質(zhì)量升級;
促升級。
十三五”規(guī)劃
創(chuàng)新打開市場空間;
中醫(yī)藥迎來發(fā)展動能;
高性能器械、IVD前景廣闊;
精準(zhǔn)醫(yī)療新增長點;
開放醫(yī)療、商貿(mào)物流領(lǐng)域。
中國制造2025
發(fā)展針對重大疾病的化學(xué)藥、中藥、生物技術(shù)藥物新產(chǎn)品,重點包括新機制和新靶點化學(xué)藥、抗體藥物、抗體偶聯(lián)藥物、全新結(jié)構(gòu)蛋白及多肽藥物、新型疫苗、臨床優(yōu)勢突出的創(chuàng)新中藥及個性化治療藥物。
提高醫(yī)療器械的創(chuàng)新能力和產(chǎn)業(yè)化水平,重點發(fā)展影像設(shè)備、醫(yī)用機器人等高性能診療設(shè)備,全降解血管支架等高值醫(yī)用耗材,可穿戴、遠(yuǎn)程診療等移動醫(yī)療產(chǎn)品。
實現(xiàn)生物3D打印、誘導(dǎo)多能干細(xì)胞等新技術(shù)的突破和應(yīng)用。
信息來源:新康界