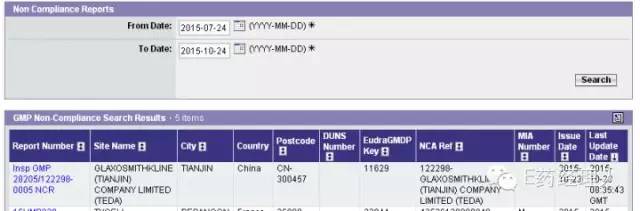
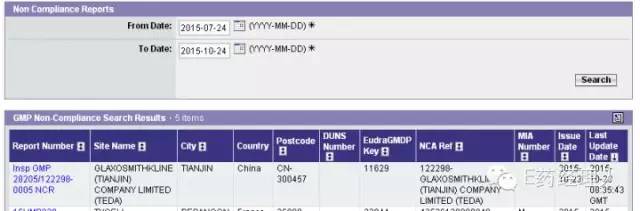
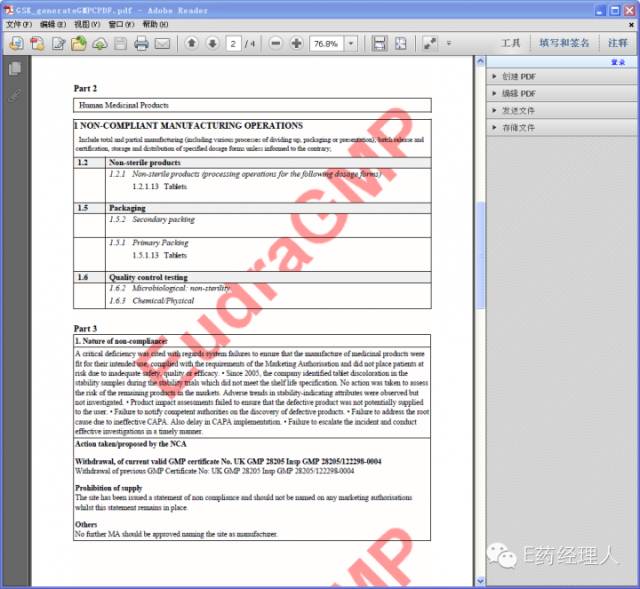
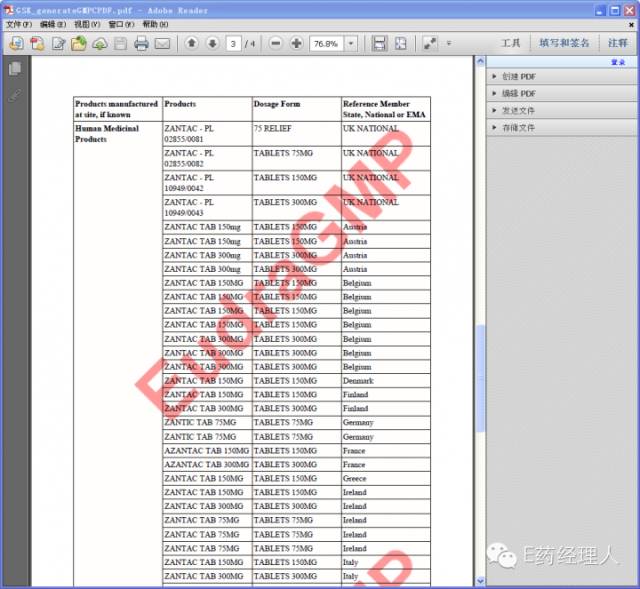
|
公司地址:浙江省寧波市鄞州區(qū)嵩江西路321號 傳真:0574-27788216
版權(quán)所用:寧波市鄞州醫(yī)藥藥材有限公司 | 英特明州(寧波)醫(yī)藥有限公司 技術(shù)支持:奇才科技
藥品成藥分公司:0574-27788200 27788220 英特明州(寧波)醫(yī)藥有限公司:0574-28831176 28831172
中藥參茸分公司:0574-27788238 27788248
版權(quán)所用:寧波市鄞州醫(yī)藥藥材有限公司 | 英特明州(寧波)醫(yī)藥有限公司 技術(shù)支持:奇才科技
藥品成藥分公司:0574-27788200 27788220 英特明州(寧波)醫(yī)藥有限公司:0574-28831176 28831172
中藥參茸分公司:0574-27788238 27788248