在近日銀杏葉事件漸漸淡出媒體公眾關注焦點的時候,7月31日,CFDA又出重拳,公布了《關于公布銀杏葉藥品專項監督抽驗第二批結果的通告(2015年第47號)》,其中涉及31家藥品生產企業,118批次不合格藥品。
在被抽查出不合格的118批次藥品中,共檢出4家企業16批藥品企業自檢合格,但是CFDA檢驗結果為不合格的。其中3家企業存在調換留樣等嚴重違法行為,藥監部門將進一步立案調查,若確定企業自檢結果不可靠,這個問題相對而言則更加嚴重。

2015年6月16日到7月20日,食品藥品監管總局先后組織北京、河北、遼寧、吉林、江蘇、浙江、廣東、廣西、重慶、四川、陜西、甘肅等12省(區、市)食品藥品監管部門對市場上銷售的銀杏葉片(含分散片)、銀杏葉膠囊進行了監督檢查和抽樣,按照食品藥品監管總局公布的補充檢驗方法進行檢驗。7月2日,食品藥品監管總局發布《關于公布銀杏葉藥品專項監督抽驗初步結果的通告》(2015年第25號),公布了第一批抽驗結果。現將第二批抽驗結果通告如下:
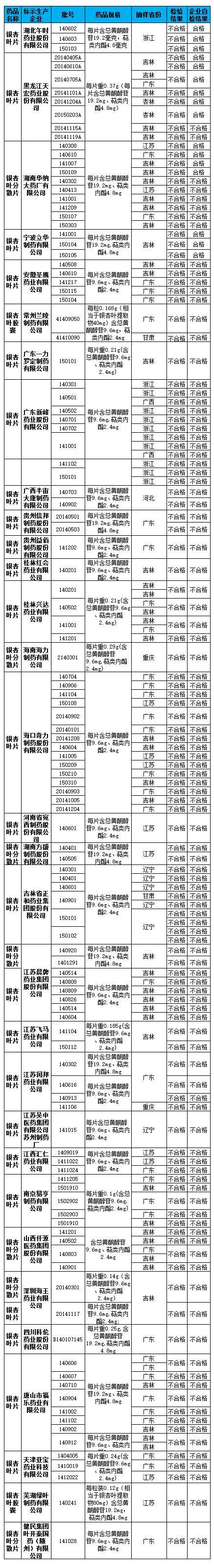
一、在抽驗的194批藥品中檢出不合格藥品118批,涉及31家藥品生產企業(詳見附件)。有29家企業102批藥品為企業自檢不合格,監督抽驗結果與企業自檢結果一致,相關企業已采取召回措施并公布了召回信息。
二、共檢出4家企業16批藥品企業自檢合格,監督抽驗結果不合格。其中,新發現湖北午時藥業股份有限公司自檢結果與監督抽驗結果不一致。該企業原自檢全部合格,本次抽驗發現140602、140603、150103三個批次的銀杏葉片不合格,表明該企業自檢結果不可靠或自檢樣品與市售產品不一致。湖北午時藥業股份有限公司應立即啟動全部批次藥品的召回。湖北省食品藥品監管局應對該企業自檢結果與監督抽驗結果不一致的問題進行調查,如存在調換留樣等行為,依法從重查處。調查結果于8月10日前報告食品藥品監管總局,并向社會公開。
食品藥品監管總局《關于公布銀杏葉藥品專項監督抽驗初步結果的通告》(2015年第25號)中已公布的4家自檢結果與監督抽驗結果不一致的企業中,3家企業再次檢出13批藥品自檢結果與監督抽驗結果不一致,分別為黑龍江天宏藥業股份有限公司(6批)、湖南華納大藥廠有限公司(4批)、寧波立華制藥有限公司(3批)。該3家企業已對全部市售有效期內產品實施召回,相關省食品藥品監管局應監督企業盡快召回到位。
三、食品藥品監管總局2015年第25號通告中公布的4家自檢結果與監督抽驗結果不一致的企業,調查結果如下:
經黑龍江、吉林、浙江省食品藥品監管局深入調查確認,黑龍江天宏藥業股份有限公司、吉林省跨海生化藥業制造有限公司、寧波立華制藥有限公司存在調換留樣等嚴重違法行為,目前當地食品藥品監管部門已對相關企業予以立案調查。
經湖南省食品藥品監管局調查認為,湖南華納大藥廠有限公司6批產品經自檢合格但監督抽驗不合格問題,系該企業工作疏漏,上報信息錯誤所致。企業網站顯示,該企業于2015年6月1日起即對包括該6批產品在內的所有不合格藥品采取了召回措施,并在6月18日前上報給湖南省食品藥品監管局的自檢匯總材料中予以確認。
四、監督抽驗中發現9家藥品生產企業未在規定時限內完成產品召回,分別是:吉林省正和藥業集團股份有限公司、江蘇潤邦藥業有限公司、常州蘭陵制藥有限公司、江蘇吳中醫藥集團有限公司蘇州制藥廠、廣東新峰藥業股份有限公司、廣西半宙大康制藥有限公司、海口奇力制藥股份有限公司、海南海力制藥有限公司、四川科倫藥業股份有限公司。企業所在地食品藥品監管部門要督促企業限期完成召回工作。
五、監督抽驗中未抽到樣品的企業有14家,具體情況為:涿州東樂制藥有限公司、山西普德藥業股份有限公司、哈藥集團世一堂制藥廠、江蘇美通制藥有限公司、江蘇蘇中藥業集團股份有限公司、萬邦德(湖南)天然藥物有限公司、廣東環球制藥有限公司、海南省金島制藥廠等8家企業根據前期的風險評估或自檢結果已對全部市售產品進行了召回;華潤三九(黃石)藥業有限公司、海南亞洲制藥有限公司2家企業所生產藥品未上市銷售;魯南厚普制藥有限公司、長春海外制藥集團有限公司、江蘇康緣藥業股份有限公司3家企業經自檢后僅有1~2批合格產品在市場上銷售,因概率問題沒被抽到;遠大醫藥黃石飛云制藥有限公司生產的銀杏葉片全部在湖北銷售,此次專項抽驗未在湖北省進行。請湖北省食品藥品監管局對市場上銷售的遠大醫藥黃石飛云制藥有限公司的產品進行抽驗。
六、綜合兩階段專項監督抽驗情況,抽樣企業覆蓋率達到78%,產品批次覆蓋率達到12%。抽驗結果表明絕大多數藥品生產企業自檢結果可信。在企業自檢2000多批不合格藥品中,共抽到185批,銀杏葉藥品市場已得到較好的凈化。監督抽驗發現有的藥品生產企業對已經出現的藥品質量問題,不是考慮如何消除危害,而采取調換留樣偽造證據、逃避監管的違法行為,情節嚴重。食品藥品監管總局要求相關省食品藥品監管部門依法嚴肅查處,并追究企業質量負責人及有關人員的責任,處理結果及時向社會公開。
七、各醫療機構和零售藥店應認真核對產品批號等信息,發現公布的不合格藥品應立即停止銷售使用并向當地食品藥品監管部門報告。對合格藥品應正常銷售使用,保障患者用藥需要。對消費者個人手中持有的不合格藥品,銷售單位均應全部回收并全額退款。
特此通告。
附件:銀杏葉藥品專項監督抽驗不合格產品信息
食品藥品監管總局
2015年7月31日
信息來源:賽柏藍